Интраоперационное гистологическое исследование замороженных срезов участков предстательной железы, прилегающих к сосудисто-нервному пучку: первичный опыт применения при робот-ассистированной радикальной простатэктомии
Реферат. Цель исследования - разработка и первичная оценка эффективности собственной методики срочного интраоперационного гистологического исследования прилегающих к сосудисто-нервному пучку участков предстательной железы при выполнении нервосберегающей робот-ассистированной радикальной простатэктомии. Материал и методы. В проспективную группу исследования включены пациенты с раком предстательной железы с сохранной предоперационной эректильной функцией, перенесшие робот-ассистированную радикальную простатэктомию с нервосберегающей техникой в период с марта по май 2019 г. Контрольная группа представлена пациентами с раком предстательной железы, перенесшими нервосберегающую робот-ассистированную радикальную простатэктомию без срочного гистологического исследования с января по май 2019 г. Наличие опухолевой ткани в окрашенном крае резекции определялось как положительный хирургический край. При всех видах статистического анализа за достоверное принималось значение p<0,05. Для статистической обработки информации использовалось программное обеспечение GraphPad Prism 8. Результаты и их обсуждение. Группы исследования оказались сравнимы по уровню простатического специфического антигена, объему простаты и индексу массы тела. Медиана времени выполнения методики срочного гистологического исследования составила 26 мин, при этом общее операционное время оказалось практически идентичным в обеих группах. Несмотря на большую распространенность экстракапсулярной экстензии в группе исследования (30 и 5,5%), ни в одном случае при использовании методики срочного гистологического исследования во время нервосберегающей радикальной простатэктомии не было выявлено положительного хирургического края, при этом во всех случаях последующее окончательное гистологическое исследование препарата подтвердило интраоперационные данные. В то же время положительный статус хирургического края при нервосберегающей радикальной простатэктомии без срочного интраоперационного исследования отмечен в 7,41% случаев. Выводы. Инициальная оценка результатов интраоперационного гистологического исследования замороженных срезов участков предстательной железы, прилегающих к сосудисто-нервному пучку, демонстрировала снижение частоты позитивных хирургических краев и указывала на потенциальную целесообразность дальнейшего клинического применения методики. Последующий анализ позволит оценить ее эффективность в отношении онкологических исходов и частоты восстановления эректильной функции после операции.
Для ссылки: Интраоперационное гистологическое исследование замороженных срезов участков предстательной железы, прилегающих к сосудисто-нервному пучку: первичный опыт применения при робот-ассистированной радикальной простатэктомии / Е.А. Соколов, Е.И. Велиев, О.В. Паклина, Г.В. Кнышинский // Вестник современной клинической медицины. – 2019. – Т. 12, вып. 6. – С.66–71. DOI: 10.20969/VSKM.2019.12(6).66-71.
Введение. Согласно глобальной интерактивной базе данных Международного агентства по изучению рака (GLOBOCAN) за 2018 г., рак предстательной железы (РПЖ) – второе по частоте злокачественное новообразование у мужчин после рака легких (1 276 106 новых зарегистрированных случаев, т.е. 7,1% от всех раковых заболеваний) и причина 358 989 смертей (3,8% от всех смертей от раковых заболеваний у мужчин) [1]. Радикальная простатэктомия (РПЭ) является одним из основных методов лечения пациентов с клинически локализованным РПЖ, однако может оказывать негативное влияние на сексуальную функцию и мочеиспускание, снижая качество жизни пациентов [2]. Нервосберегающая техника РПЭ, подразумевающая сохранение сосудисто-нервных пучков, расположенных между фасциальными листками в заднебоковых отделах простаты, позволяет минимизировать побочные эффекты лечения и положительно влияет на восстановление эректильной функции после операции [3]. Сохранение сосудисто-нервных пучков рекомендуется пациентам с низким риском экстракапсулярной экстензии опухоли, при этом некоторые исследования указывают на относительную безопасность нервосберегающей техники у отобранных больных РПЖ из высокой группы риска развития рецидива [4]. Предложены различные варианты техники сохранения сосудисто-нервных пучков при РПЭ, однако любое сохранение перипростатической ткани потенциально может увеличивать риск положительного хирургического края (ХК) и, соответственно, биохимического рецидива РПЖ [5].
Несмотря на потенциальную пользу использования данных мультипараметрической магнитно- резонансной томографии (МРТ) и предоперационных номограмм для селекции пациентов при планировании РПЭ, значимое количество случаев сохранения сосудисто-нервных пучков сопровождается неблагоприятными патоморфологическими находками, способными в дальнейшем оказать негативное влияние на онкологические результаты [6]. Одним из вариантов оптимизации онкологической безопасности нервосберегающей РПЭ является предложенная T. Schlomm et al. [7] методика срочного гистологического исследования прилегающих к сосудисто-нервному пучку зон простаты («NeuroSAFE»).
Цель данного исследования - разработка, адаптация и первичная оценка эффективности собственной методики срочного интраоперационного гистологического исследования прилегающих к сосудисто-нервному пучку участков предстательной железы при выполнении нервосберегающей робот- ассистированной РПЭ.
Материал и методы. Дизайн и группа исследования. Проспективное нерандомизированное исследование выполнено на научно-клинической базе кафедры урологии и хирургической андрологии Российской медицинской академии непрерывного профессионального образования и клиники урологии ГКБ им. С.П. Боткина (г. Москва). В группу исследования включено 10 пациентов с РПЖ с сохранной предоперационной эректильной функцией, которым была выполнена робот-ассистированная РПЭ с нервосберегающей техникой в период с марта по май 2019 г. Критериями отбора для выполнения срочного интраоперационного гистологического исследования являлось наличие по данным предоперационного обследования двустороннего РПЖ высокого риска и/или наличие очага РПЖ со стороны предполагаемого сохранения сосудисто-нервного пучка по данным мультипараметрической МРТ. В контрольную группу включено 54 пациента с РПЖ, перенесших нервосберегающую робот-ассистированную РПЭ с января по май 2019 г. без срочного гистологического исследования. Оперативные вмешательства выполнялись двумя хирургами с использованием роботизированной хирургической системы da Vinci Si (Intuitive Surgical®) трансперитонеальным доступом. Срочные гистологические исследования и окончательное гистологическое исследование всех удаленных препаратов (предстательная железа с семенными пузырьками; при наличии – лимфатические узлы, отдельные участки дистальной уретры/шейки мочевого пузыря) проводились в патологоанатомическом отделении ГКБ им. С.П. Боткина. Наличие опухолевой ткани в окрашенном крае резекции определялось как положительный ХК. Сравнение частоты позитивных ХК между группами являлось конечной точкой исследования. Информированное согласие на участие в исследование подписано всеми включенными в исследование пациентами, работа одобрена этическим комитетом учреждения.
Техника интраоперационного гистологического исследования замороженных срезов участков предстательной железы, прилегающих к сосудисто-нервному пучку. При разработке собственной методики за основу взято исследование T. Schlomm et al. [7] и последующая адаптация для робот-ассистированной хирургии этой же группой авторов [8]. После удаления предстательная железа с семенными пузырьками помещается в заранее введенный в брюшную полость эндоскопический мешок. Извлечение препарата не требует полного отключения роботической системы: выполняется отключение камеры (рис. 1), после чего камера вводится в латеральный ассистентский порт и препарат под контролем зрения извлекается через супраумбиликальный разрез для порта камеры.
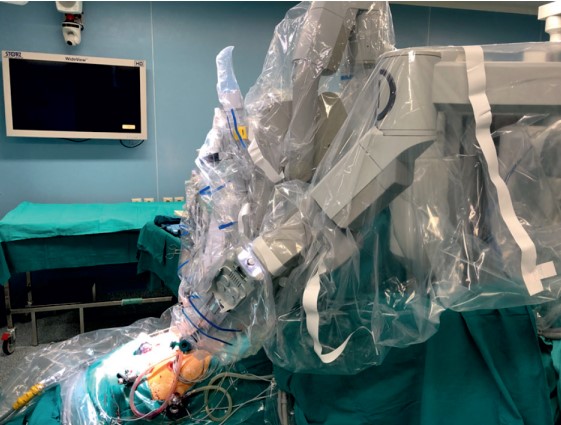 Рис. 1. Отключенный порт камеры роботической системы для извлечения препарата с целью выполнения срочного гистологического исследования
Рис. 1. Отключенный порт камеры роботической системы для извлечения препарата с целью выполнения срочного гистологического исследования
После извлечения препарат направляется в патолого-анатомическое отделение, где предварительно информированный специалист сразу приступает к обработке материала. В зависимости от запроса хирурга, выполняется одно- или двустороннее исследование участков предстательной железы, прилегающих к сосудисто-нервному пучку. Иссекается большой образец ткани (рис. 2А), включающий всю заднебоковую область простаты, максимально прилегающую к сосудисто-нервному пучку [9]. С целью улучшения ориентации наружная поверхность образца окрашивается в различные цвета в зоне апекса и базиса (см. рис. 2Б). Далее образец ткани замораживается в криостате при температуре минус 27°С и формируются срезы наружного края толщиной 7-9 мкм (см. рис. 2В), после чего срезы фиксируются на предметном стекле, окрашиваются гематоксилин-эозином и исследуются морфологом (см. рис. 2Г).
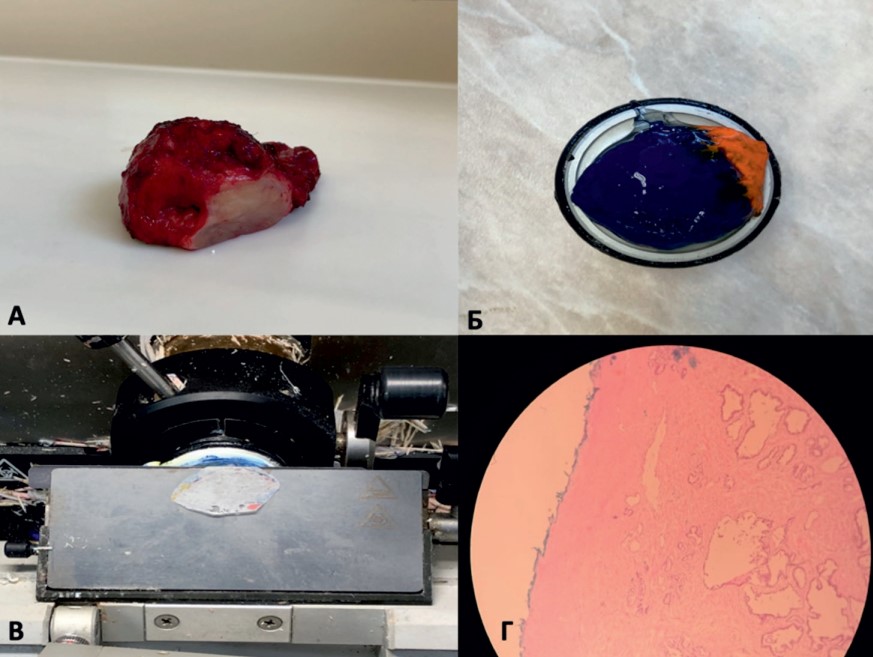
Рис. 2. А - предстательная железа с иссеченной левой заднебоковой областью;
Б - окрашенный иссеченный участок; В — криосрез наружного края;
Г - окрашенный гематоксилин-эозином препарат; отсутствие опухоли по краю капсулы
Во время обработки и исследования препарата супраумбиликальный разрез ушивается узловыми швами Викрил 0, порт для камеры вводится в брюшную полость, камера подключается к роботической системе, восстанавливается карбоксиперитонеум, осуществляется гемостаз, формируется везикоуретральный анастомоз при наличии показаний выполняется расширенная тазовая лимфаденэктомия. Таким образом, практически исключается увеличение времени оперативного вмешательства. После получения информации о негативном стату- се ХК операция завершается, при наличии положительного ХК выполняется резекция сохраненного сосудисто-нервного пучка. Стандартизирование исследуемой зоны простаты, иссечение области интереса информированным морфологом, а не хирургом, а также окраска и выполнение крио- срезов только наружной поверхности являются особенностями нашей методики, оптимизирующими время выполнения без ухудшения (по первым данным) качества исследования. Для удобства использования в клинической практике и дальнейших научных исследований для наименования методики выбрана аббревиатура ЦИКЛОП - «cito (цито) исследование края латеральной области простаты».
Статистический анализ и обработка информации. Для оценки непрерывных переменных использовался U-тест Манна Уитни, при сравнительном анализе категориальных данных использовался тест X2 Пирсона. При всех видах статистического анализа за достоверное принималось значение p<0,05. Для статистической обработки информации использовалось программное обес- печение GraphPad Prism 8 (Graph Pad Software Inc, La Jolla, CA, USA).
Результаты и их обсуждение. Клинические характеристики пациентов группы исследования и контрольной группы представлены в табл. 1. Основная цель исследования заключалась в оценке первичных результатов внедрения и использования методики ЦИКЛОП. Для понимания общих тенденций мы включили в исследование контрольную группу, однако, учитывая малое количество наблюдений, сравнительный анализ позволяет делать лишь предварительные выводы. Пациенты из группы исследования были несколько моложе, при этом группы исследования оказались сравнимы по уровню простатического специфического антигена, объему простаты и индексу массы тела. Медиана времени выполнения методики срочного гистологического исследования от момента извлечения предстательной железы до получения информации о статусе ХК составила 26 мин (19—36), при этом общее операционное время оказалось практически идентичным в обеих группах: 180 и 175 мин (p=0,98). Стоит отметить, что время выполнения методики ЦИКЛОП зависит от необходимости одно- или двустороннего исследования.
Таблица 1
Сравнительные клинические характеристики групп
| Характеристика пациентов | Группа исследования (n=10) | Группа контроля (n=54) | p |
|---|---|---|---|
| Средний возраст на момент РПЭ, лет | 57,6 (±5,4) | 61,3 (±5,2) | 0,05 |
| ПСА перед РПЭ, нг/мл (медиана) | 7 (5,8–11,5) | 7 (6–8) | 0,6 |
| Объем простаты, см³ (медиана) | 44 (29,3–54) | 41 (32–55) | 0,96 |
| Индекс массы тела, кг/м² (медиана) | 26,5 (24,8–31) | 27 (24,3–29) | 0,97 |
| Предоперационная группа риска развития рецидива (EAU 2019): низкий риск, чел. (%) промежуточный риск, чел. (%) высокий риск, чел. (%) |
2 (20) 5 (50) 3 (30) |
26 (48,2) 18 (33,3) 10 (18,5) |
0,1 0,3 0,4 |
| Операционное время, мин (медиана) | 180 (155–225) | 175 (160–205) | 0,98 |
| Кровопотеря, мл (медиана) | 80 (50–100) | 100 (50–150) | 0,2 |
Примечание. РПЭ – радикальная простатэктомия; ПСА – простатический специфический антиген; EAU – Европейская ассоциация урологии.
Учитывая изначальную целесообразность использования интраоперационного гистологического исследования в случаях, когда сохранение сосудисто-нервного пучка сопряжено с высоким онкологическим риском, большая часть группы исследования представлена пациентами промежуточного и высокого риска развития рецидива. Косвенно это подтверждается тем фактом, что экстракапсулярная экстензия существенно чаще была отмечена в группе исследования: 30 и 5,5% (p=0,015). Ни в одном случае при использовании методики ЦИКЛОП во время нервосберегающей РПЭ не было выявлено положительного ХК, при этом во всех случаях последующее полное гистологическое исследование препарата подтвердило данные интраоперационного исследования. В то же время, несмотря на большую долю пациентов низкого риска и меньшую частоту экстракапсулярной экстензии опухоли, положительный статус ХК при нервосберегающей РПЭ без срочного интраоперационного исследования отмечен в 7,41% случаев (табл. 2).
Таблица 2
Неблагоприятные патоморфологические находки
| Характеристика пациентов | Группа исследования (n=10) | Группа контроля (n=54) | p | ||
|---|---|---|---|---|---|
| Абс. число | % | Абс. число | % | ||
| Наличие ЭКЭ после РПЭ (повышение стадии до рТ3) | 3 | 30 | 3 | 5,5 | 0,015 |
| Наличие положительного ХК после РПЭ | 0 | 0 | 4 | 7,41 | 0,37 |
Примечание. РПЭ – радикальная простатэктомия; ЭКЭ – экстракапсулярная экстензия.
Негативный статус ХК не всегда исключает развитие рецидива РПЖ, который может возникнуть как вследствие наличия метастатических отсевов в лимфатических узлах, так и по причине возможного ложнонегативного результата, когда признаки малигнизации могут быть выявлены лишь при иммуногистохимическом исследовании [10]. В то же время позитивный статус ХК после РПЭ является значимым предиктором развития биохимического рецидива, в особенности при использовании техники нервосбережения [11]. Более того, в отличие от оперативного вмешательства при местно-распространенном процессе, когда радикальное иссечение может быть технически невозможным, положительный ХК при сохранении сосудисто-нервных пучков зачастую является ятрогенным и обусловлен либо диссекцией «по опухоли», либо недостаточным предоперационным обследованием пациентов. Мультипараметрическая МРТ и номограммы, прогнозирующие риск экстракапсулярной экстензии, могут быть полезны при селекции пациентов для нервосберегающей техники, однако неспособны полностью исключить риск наличия остаточной опухоли после операции [12].
Полученные нами данные подтверждают результаты предшествующих исследований, указывающих на высокую эффективность методики срочного гистологического исследования прилегающих к сосудисто-нервному пучку участков простаты в отношении снижения частоты позитивных ХК при нервосберегающей РПЭ. Уже отмеченный нами протокол «NeuroSAFE» и его адаптация для роботической хирургии позволили существенно расширить показания к одно- или двусторонней нервосберегающей технике и увеличить ее использование с 81 до 97% (p<0,0001), в том числе при рТ3а/ pT3b, при этом снизив частоту позитивных ХК на 7,8% (р=0,0037) [8]. Схожие результаты получены в работе F. Preisser et al. [13], суммарно включавшей 346 пациентов. Внедрение интраоперационного исследования замороженных срезов простаты привело к увеличению частоты сохранения сосудисто- нервных пучков с 55,3 до 95,5% (p<0,001) и снизило частоту позитивных ХК на 14,1% (p=0,003). В другом исследовании G. Mirmilstein et al. [14] пришли к аналогичным выводам, отметив, что использование методики срочного гистологического исследования нашло отражение также в восстановлении эректильной функции через 12 мес после РПЭ: 77,3 и 50,9% (р=0,009) при двустороннем нервосбережении и 70,6 и 40% (p=0,04) при одностороннем нервосбережении. По мнению авторов, причиной этого является возможность полного сохранения пучка при интраоперационном гистологическом подтверждении отрицательного ХК, в то время как в других случаях иногда приходится ограничиваться частичным сохранением.
Ограничением нашей работы является малая выборка пациентов. Тем не менее первичные результаты указывают на высокую эффективность использования собственного варианта методики в клинической практике. Более того, учитывая результаты основных международных исследований, потенциальные преимущества могут заключаться не только в снижении частоты позитивных ХК и улучшении онкологических результатов, но и в более широком применении нервосберегающей техники РПЭ и лучшем восстановлении эректильной функции, что может благоприятно сказаться на качестве жизни пациентов.
Выводы. Инициальная оценка результатов использования при нервосберегающей РПЭ интраоперационного гистологического исследования замороженных срезов участков предстательной железы, прилегающих к сосудисто-нервному пучку, демонстрирует явную тенденцию к снижению частоты позитивных ХК и указывает на потенциальную целесообразность его клинического применения. Дальнейший анализ позволит оценить эффективность методики в отношении оптимизации онкологических исходов, расширения показаний к сохранению сосудисто-нервных пучков и частоты восстановления эректильной функции после операции.
Прозрачность исследования. Исследование не имело спонсорской поддержки. Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать.
Декларация о финансовых и других взаимоотношениях. Все авторы принимали участие в разработке концепции, дизайна исследования и в написании рукописи. Окончательная версия была одобрена всеми авторами. Авторы не получали гонорар за исследование.








