Робот-ассистированные операции у больных с большими и гигантскими грыжами пищеводного отверстия диафрагмы
Резюме
Цель исследования — определить возможность и целесообразность применения роботизированного хирургического комплекса (РХК) в лечении пациентов с грыжами пищеводного отверстия диафрагмы.
Материал и методы. В исследование включены 37 пациентов (средний возраст 56,2±10,9 года). У 22 (60%) больных диагностировали кардиофундальную, у 13 (35%) — субтотальную и у 2 (5%) — тотальную грыжи пищеводного отверстия диафрагмы (ГПОД). У 18 (48%) больных наблюдали сопутствующие заболевания: язвенную болезнь желудка и двенадцатиперстной кишки (ДПК) у 8 (22%), желчно- каменную болезнь у 7 (19%) и пищевод Барретта с дисплазией эпителия низкой степени у 4 (11%). Всем пациентам выполняли робот- ассистированную фундопликацию в модификации А.Ф. Черноусова с крурорафией без использования сетчатых эндопротезов. Операции выполняла одна бригада хирургов на РХК Da Vinci Si (Intuitive Surgical, Sunnyvale, CA). Результаты. Средняя продолжительность операции составила 122±37 мин. Средняя кровопотеря — 20±9 мл. Ни в одном из наблюдений не было конверсии доступа и повторного вмешательства в раннем послеоперационном периоде. Крурорафию выполнили 31 (85%) пациенту, при этом 10 (26%) пациентам — заднюю и переднюю одновременно. Средний срок пребывания в стационаре составил 5,0±1,3 сут. Медиана наблюдения — 14,0±3,6 мес. В отдаленном периоде проведенное комплексное обследование не выявило рецидива ГПОД или гастроэзофагеального рефлюкса.
Заключение. Проведенный анализ позволил сделать выводы о том, что выполнение робот-ассистированных операций безопасно, является целесообразным и оправданным у больных с кардиофундальными, субтотальными и тотальными ГПОД. Считаем неоправданным использование РХК в хирургическом лечении пациентов с рефлюкс-эзофагитом и/или кардиальной ГПОД в связи с отсутствием доказанных преимуществ перед аналогичными лапароскопическими операциями.
Актуальность
История изучения грыж пищеводного отверстия диафрагмы (ГПОД) насчитывает более четырех столетий. Однако до начала XX в. в литературе были описаны лишь единичные наблюдения, да и те, основанные на аутопсии. Первое описание хирургического лечения ГПОД опубликовал в 1919 г. Angelo L. Soresi [1]. В тот период хирургические вмешательства были скорее экспериментальными и основывались на анатомических наблюдениях. Почти за 100-летнюю историю хирургии ГПОД и рефлюкс-эзофагита было предложено множество способов хирургического лечения. Все применявшиеся когда-либо методы можно разделить на выполняемые из трансторакального и трансабдоминального доступов [2], а также на четыре группы [1, 3—5]:
1) операции, суживающие пищеводное отверстие диафрагмы (ПОД) и укрепляющие пищеводно-диафрагмальную связку (Soresi, Harrington, Allison, Madden, Johnsrud, Wangensteen, Brain, Maynard, Stewart, Merendino, Петровский и др.);
2) операции, восстанавливающие угол Гиса (Lataste, Mustard, Allison, Lortat-Jacob, Barrett, Gertz, Husfeldt, Collis, Каншин и др.);
3) гастрокардиопексия (Boerema, Nissen, Hill, Mustard, Pedinelli, Rampal); 4) фундопликация (Nissen, Rossetti, Toupet, Belsey, Каншин, Черноусов, Шалимов и др.).
В первой половине XX века основное внимание специалистов было уделено всевозможным методам хирургического устранения грыжи, что, по мнению многих из них, должно было ликвидировать клинические проявления рефлюкс-эзофагита. К сожалению, после этих операций отмечали до 47% рецидивов ГПОД, и у 66% оперированных больных сохранялись клинические признаки гастроэзофагеального рефлюкса. По мнению ряда авторов [3, 4, 6], подобные операции позволяют ликвидировать лишь собственно ГПОД, но не приводят к излечению рефлюксэзофагита, поскольку не направлены на восстановление запирательной функции кардии. Хирурги были склонны объяснять рецидивы симптомов недостаточной степенью сужения пищеводного отверстия диафрагмы, а некоторые, например F. Saeurbruch, вовсе попробовали расширять пищеводное отверстие диафрагмы для уменьшения предполагаемого сдавления желудка и натяжения тканей [1].
Вторая половина XX века ознаменовалась борьбой с гастроэзофагеальным рефлюксом и его осложнениями. Несмотря на большое число предложенных методов антирефлюксной коррекции (Nissen, Toupet, Dor, Hill, Belsey, Collis и др.), в литературе и сейчас можно найти немало противоречивых результатов проведенного хирургического лечения. К тому же на сегодняшний день ни одно международное профессиональное хирургическое сообщество не может рекомендовать одну, наиболее эффективную методику лечения ГПОД и гастроэзофагеального рефлюкса. Неудовлетворительные результаты и осложнения после наиболее распространенных антирефлюксных методик побудили целый ряд хирургов вновь акцентировать свое внимание на коррекции ГПОД и крурорафии, используя для этого с 1993 г. синтетические эндопротезы по аналогии с лечением грыж передней брюшной стенки [7]. Примерно с того же периода стали появляться работы, посвященные осложнениям пластики ПОД сетчатыми эндопротезами — дисфагии, миграции, пролежню, кровотечению и др. Сегодня необходимость использования синтетических материалов, выбор оптимальных видов, способов их фиксации, расположения по отношению к пищеводу остаются предметом оживленных дискуссий и разногласий [3, 5, 8, 9].
Активное развитие эндовидеохирургических технологий и первая лапароскопическая фундопликация в 1991 г. ожидаемо привели к прогрессивному увеличению числа антирефлюксных операций во всем мире. Логичным продолжением и развитием лапароскопического направления стало появление в 2000 г. роботизированного хирургического комплекса (РХК) Da Vinci, и выполненная тогда же первая робот-ассистированная фундопликация (robot-assisted fundoplication — RAF) Nissen. В настоящее время в мире накоплен небольшой опыт применения РХК в лечении пациентов с рефлюкс-эзофагитом и ГПОД, однако число ежегодно выполняемых операций постепенно увеличивается. Остается дискутабельным вопрос о целесообразности применения РХК у больных с ГПОД и рефлюкс-эзофагитом ввиду малого числа проведенных исследований и их противоречивых результатов.
Материал и методы
В исследование включены 37 пациентов с большими и гигантскими ГПОД и осложненным рефлюксэзофагитом, находившиеся на лечении в Клинике факультетской хирургии им. Н.Н. Бурденко Сеченовского университета в период с 2015 по 2018 г. В клинической практике мы используем наиболее удобную и распространенную в отечественной литературе классификацию ГПОД, предложенную Б.В. Петровским и Н.Н. Каншиным, которая в полной мере отражает диагностируемые топографоанатомические изменения и размеры грыжи. По международной классификации ГПОД все случаи, вошедшие в данное исследование, можно отнести к III и IV типу.
Основные характеристики и клинические симптомы пациентов были собраны и проанализированы ретроспективно на основании электронной базы данных клиники. Лечение больных проводили в соответствии с перечнем видов высокотехнологичной медицинской помощи, которая осуществляется за счет субвенций из бюджета Федерального фонда обязательного медицинского страхования, в связи с этим экономическая эффективность проведенных операций не оценивалась. Характерные жалобы на изжогу предъявляли 25 (67%) больных, на дискомфорт за грудиной — 29 (78%) и отрыжку воздухом — 26 (71%). У 11 (33%) пациентов (у 7 — с тотальной и 4 — с субтотальной ГПОД) была дисфагия II—III степени, обусловленная сдавлением пищевода желудком, практически полностью расположенным в заднем средостении (табл. 1). Срыгивание съеденной пищи отмечали 22 (59%) пациента, при этом у 5 (15%) больных с тотальной ГПОД симптом, скорее всего, был обусловлен дисфагией, у остальных 10 (26%) с кардиофундальной и 7 (19%) с субтотальной ГПОД — несостоятельностью клапанной функции кардии.
Таблица 1. Основные клинические характеристики больных (n=37)/ Table 1. Major clinical characteristics of the patients (n=37)
| Показатель | Значение |
|---|---|
| Возраст, годы | 56,2 (31—77) |
| Мужчины/женщины, n (%) | 15 (41%) / 22 (59%) |
| ИМТ (кг/м2) | 30,8 (17,1—44,3) |
| Классификация ASA, n (%) - I | 10 (26%) |
| Классификация ASA, n (%) - II | 12 (33%) |
| Классификация ASA, n (%) - III | 15 (41%) |
| Сопутствующие заболевания, n (%) - гастроэнтерологические | 18 (48%) |
| Сопутствующие заболевания, n (%) - сердечно-сосудистые | 15 (41%) |
| Сопутствующие заболевания, n (%) - бронхолегочные | 23 (63%) |
| Симптомы, n (%) - изжога | 25 (67%) |
| Симптомы, n (%) - дисфагия | 12 (33%) |
| Симптомы, n (%) - дискомфорт и боль за грудиной | 29 (78%) |
| Симптомы, n (%) - отрыжка воздухом | 26 (71%) |
| Симптомы, n (%) - срыгивание | 22 (59%) |
| Классификация ГПОД (Б.В. Петровский, 1965), n (%) - кардиофундальная | 22 (60%) |
| Классификация ГПОД (Б.В. Петровский, 1965), n (%) - субтотальная | 13 (35%) |
| Классификация ГПОД (Б.В. Петровский, 1965), n (%) - тотальная | 2 (5%) |
| Классификация рефлюкс-эзофагита (А.Ф. Черноусов, 1973), n (%) - легкий рефлюкс-эзофагит | 8 (22%) |
| Классификация рефлюкс-эзофагита (А.Ф. Черноусов, 1973), n (%) - рефлюкс-эзофагит средней степени тяжести | 15 (41%) |
| Классификация рефлюкс-эзофагита (А.Ф. Черноусов, 1973), n (%) - эрозивный рефлюкс-эзофагит | 14 (37%) |
У всех больных при эзофагогастродуоденоскопии были выявлены признаки эзофагита различной степени тяжести согласно эндоскопической классификации рефлюкс-эзофагита (А.Ф. Черноусов, 1973). По результатам рентгенологического исследования и в соответствии с классификацией Б.В. Петровского и соавт., кардиофундальная грыжа диагностирована у 22 (60%), субтотальная — у 13 (35%) и тотальная ГПОД — у 2 (5%) пациентов (рис. 1, на цв. вклейке).
Средний индекс массы тела у больных составил 30,8 (17,1—44,3) кг/м2, что соответствует алиментарно-конституциональному ожирению I степени. В соответствии с системой предоперационной классификации физического статуса пациентов Американского общества анестезиологов преобладали пациенты II (33%) и III (41%) класса физического здоровья. Общий соматический статус был отягощен наличием у 23 (63%) пациентов бронхолегочных заболеваний, таких как бронхиальная астма у 6 (15%) и хронический бронхит и/или ларингит у 18 (48%) больных, которые были обусловлены аспирационным синдромом и высоким гастроэзофагеальным рефлюксом на фоне кардиофундальной или субтотальной ГПОД. Сердечно-сосудистыми заболеваниями, такими как гипертоническая болезнь и ишемическая болезнь сердца, страдали 15 (41%) пациентов, участвовавших в исследовании. У 18 (48%) больных наблюдали сопутствующие гастроэнтерологические заболевания: язвенную болезнь желудка и ДПК у 8 (22%), желчнокаменную болезнь у 7 (19%) и пищевод Барретта с дисплазией эпителия низкой степени у 4 (11%) .
Всем включенным в исследование пациентам выполняли робот-ассистированную фундопликацию в модификации А.Ф. Черноусова с крурорафией и без использования сетчатых имплантатов. Операции выполняла одна бригада хирургов на РХК Da Vinci Si (Intuitive Surgical, Sunnyvale, CA). Положение больного на столе и расстановка троакаров были аналогичны таковым при лапароскопических операциях (рис. 2). Расстояние между камерой и инструментальными портами для роботизированных инструментов составляло не менее 8—10 см. Уменьшение этого интервала приводит к ограничению свободы действия инструментов и «конфликту» между «руками» робота. В своей практике мы отказались от использования третьего манипулятора РХК в связи с отсутствием преимуществ при его использовании и частым ограничением свободы («конфликт» с другими манипуляторами у астеничных больных). В подобной ситуации введение ассистентского 5 мм троакара является оптимальным выходом. После введения портов проводили стыковку портов с манипуляторами робота (докинг). Набор роботических инструментов включал ультразвуковые гармонические ножницы (Harmonic ACE Curved Shears) или монополярный крючок (Permanent Cautery Hook), атравматичный зажим (ProGrasp Forceps) или биполярный зажим (Fenestrated Bipolar Forceps), два иглодержателя (Large Needle Driver).
 Рис. 2. Схема расстановки троакаров. А1, А2 — ассистентские порты; C — порт камеры РХК; R1, R2 — порты «рук» 1,2 РХК. Fig. 2. Trocars positions (scheme). A1, A2 — assistant’s ports, C — RSS DaVinci Si camera port. R1, R2 — «hand’s» ports 1,2 RSS DaVinci.
Рис. 2. Схема расстановки троакаров. А1, А2 — ассистентские порты; C — порт камеры РХК; R1, R2 — порты «рук» 1,2 РХК. Fig. 2. Trocars positions (scheme). A1, A2 — assistant’s ports, C — RSS DaVinci Si camera port. R1, R2 — «hand’s» ports 1,2 RSS DaVinci.
Обладая опытом хирургического лечения более 400 больных (в том числе выполнения более 220 лапароскопических вмешательств) с различными ГПОД и осложненным рефлюкс-эзофагитом, мы впервые адаптировали к новой технологии и провели с использованием РХК фундопликацию по методике А.Ф. Черноусова, которую применяем в клинике с 2006 г. Все операции начинали с низведения желудка в брюшную полость, кроме этого, у 8 больных из средостения извлекли сальник, а у 6 пациентов — поперечную ободочную кишку. У 11 больных полное низведение желудка оказалось затруднительным ввиду укорочения пищевода I степени (5 пациентов) и сформировавшихся рубцов грыжевого мешка с дном желудка (6 пациентов). Мобилизацию начинали от ножек диафрагмы, постепенно выделяя грыжевой мешок из средостения, что упрощало тракцию желудка вниз и улучшало визуализацию основных анатомических ориентиров. Далее мобилизовали желудок по малой кривизне, кардию, дно желудка с лигированием 2—3 коротких и задней желудочной артерий. Обязательным этапом было иссечение грыжевого мешка. Стабильное увеличенное 3D-изображение высокой четкости и изгибаемые инструменты позволяли идентифицировать и не повреждать медиастинальную плевру, перикард и блуждающие нервы, что обеспечивало высокую прецизионность операции. Удлиненные по сравнению с лапароскопическими роботизированные инструменты с технологией EndoWrist позволяли проводить предельно аккуратную мобилизацию в заднем средостении вне зависимости от размеров ПОД и объема грыжевой полости. Среднее расстояние между ножками диафрагмы составляло 6,9 см (от 5 до 12 см). Всем пациентам формировали полную симметричную манжетку на толстом желудочном зонде с обязательной фиксацией ее верхней части к пищеводу в четырех точках, что исключает возможность соскальзывания и разворота даже в случае ее миграции в заднее средостение, о чем мы сообщали ранее [3]. При формирова- нии антирефлюксной манжетки всегда использовали нерассасывающийся шовный материал, а ее протяженность составляла не более 4,0—4,5 см. Заднюю крурорафию выполняли непрерывным швом нерассасывающимся шовным материалом с насечками, что препятствовало развязыванию нити и позволяло быстро ушивать ножки диафрагмы, калибруя их по диаметру пищевода (рис. 3, на цв. вклейке). При необходимости накладывали дополнительные швы спереди, но принципиально никогда не использовали при этом синтетические имплантаты. Всем больным с оставшейся полостью в заднем средостении после низведения желудка и иссечения грыжевого мешка оставляли дренаж на активной аспирации.
Оставленный тонкий декомпрессионный назогастральный зонд удаляли при отсутствии признаков гастростаза на 1—2-е сутки и разрешали дозированное питье. На 2—3-и сутки после операции, прежде чем начинать дробное питание, проводили динамическое рентгеноконтрастное исследование с использованием водорастворимого контрастного вещества.
Таблица 2. Результаты хирургического лечения (n=37) Table 2. Surgical outcomes (n=37)
| Показатель | Значение |
|---|---|
| Время операции, мин | 162,5 (75—190) |
| Кровопотеря, мл | 15 (4—67) |
| Конверсия доступа | 0 (0) |
| Осложнения (Clavien—Dindo), n (%) - I | 0 (0) |
| Осложнения (Clavien—Dindo), n (%) - II | 3 (7,4) |
| Осложнения (Clavien—Dindo), n (%) - III | 0 (0) |
| Осложнения (Clavien—Dindo), n (%) - IV | 0 (0) |
| Осложнения (Clavien—Dindo), n (%) - V | 0 (0) |
| Время пребывания в стационаре, дни | 5 (3—10) |
| Повторные операции в течение 30 дней, n (%) | 0 (0) |
| Симультанные вмешательства, n (%) | 8 (22) |
| Селективная проксимальная ваготомия | 1 (1) |
| Холецистэктомия | 7 (19) |
Результаты
Всего с использованием РХК была выполнена 41 операция. Первые 4 больных были оперированы с кардиальной ГПОД, рефлюкс-эзофагитом средней степени тяжести. Проведенный клинико-технический анализ не позволил выявить явных преимуществ перед аналогичными лапароскопическими операциями и в последующем мы отказались от применения РХК у больных с кардиальными ГПОД. Таким образом, в исследование были включены 37 пациентов, возраст которых варьировал от 29 до 68 лет (средний возраст 56,2±10,9 года). Средняя продолжительность операции составила 122±37 мин (от 75 до 190 мин), при этом мы учитывали фазу докинга РХК, но исключали время, затраченное на его включение, позиционирование и выключение (табл. 2). Средняя кровопотеря составила 20±9 мл (от 5 до 70 мл). Ни в одном из наблюдений не было конверсии доступа. Также ни один из пациентов не был повторно оперирован в раннем послеоперационном периоде. Симультанно 7 (18,5%) больным выполнили холецистэктомию по поводу желчнокаменной болезни и 1 — селективную проксимальную ваготомию по поводу рецидивирующей язвы луковицы ДПК с ее компенсированной рубцовой деформацией. Ушивание ножек диафрагмы выполнили 31 (85%) пациенту, при этом 10 (26%) из них не только заднюю, но и переднюю крурорафию. В среднем больные находились в стационаре 5,0±1,3 сут (от 3 до 12 сут). Среди интраоперационных осложнений было одно краевое ранение печени, одно кровотечение из короткой артерии желудка при неадекватной коагуляции роботическим монополярным крючком и одно локальное десерозирование стенки желудка при его тракции и низведении из средостения.
В послеоперационном периоде у 1 (3%) больного наблюдали явления гастростаза и еще у 1 — развитие временной умеренной дисфагии, вероятно, из-за сложности мануального контроля степени натяжения тканей при формировании манжетки (Clavien— Dindo II). На фоне консервативной терапии и лечебного питания явления гастростаза и дисфагии регрессировали в течение 3—5 дней. Медиана наблюдения составила 14,0±3,6 мес (от 6 до 24 мес). Всем пациентам в отдаленном периоде проводили контрольное рентгенологическое и эндоскопическое исследование пищевода, желудка и ДПК (рис. 4). Ни у одного больного не диагностировали рецидива ГПОД, у 36 (96%) пациентов наблюдали регрессию воспалительных изменений слизистой оболочки пищевода. В нашем исследовании не было конверсии доступа, а также летальных исходов, не наблюдалось рецидивов ГПОД или клинических проявлений рефлюкс-эзофагита в раннем (менее 30 сут) и отдаленном (более 6 мес) послеоперационном периоде.
Обсуждение
При анализе мировой литературы с 2001 г. нами найдено 49 публикаций, посвященных применению РХК у взрослых больных с гастроэзофагеальной рефлюксной болезнью и ГПОД. Среди них 10 обзоров литературы, 4 метаанализа, 5 рандомизированных клинических исследований, 17 когортных исследований и клинические наблюдения. Представленные результаты не позволили выявить существенных различий при сравнении робот-ассистированных и лапароскопических операций у больных с кардиальными ГПОД (I тип) и рефлюкс-эзофагитом. По числу интра- и послеоперационных осложнений, частоте конверсий и длительности госпитализации достоверных различий не получено. Использование РХК было сопряжено с увеличением времени операции и повышением себестоимости. Лишь несколько исследований продемонстрировали улучшенные результаты в группе робот-ассистированных операций за счет меньшей кровопотери и лучших показателей градиента давления в нижнем пищеводном сфинктере [10, 11].
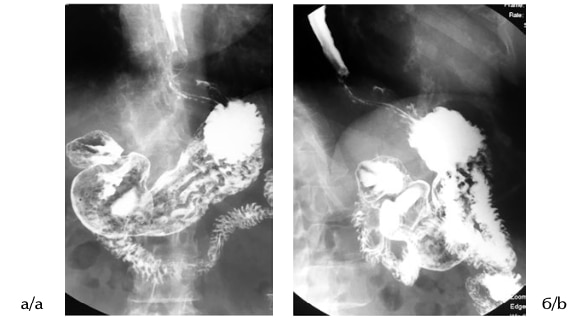 Рис. 4. Рентгенография пищевода и желудка через 6 мес после хирургического лечения. а — фронтальная проекция; б — сагиттальная проекция. Fig. 4. The esophagus and stomach radiography 6 months after surgery. a —frontal projection; b — sagittal projection.
Рис. 4. Рентгенография пищевода и желудка через 6 мес после хирургического лечения. а — фронтальная проекция; б — сагиттальная проекция. Fig. 4. The esophagus and stomach radiography 6 months after surgery. a —frontal projection; b — sagittal projection.
Стоит отметить, что все найденные нами исследования включали небольшое число наблюдений (20— 60 пациентов), авторы использовали различные методики фундопликаций, период наблюдения за больными был ограничен несколькими годами, а в большинство исследований не включало пациентов с больши- ми ГПОД и осложненным рефлюкс-эзофагитом. Так, H. Brenkman и соавт. ретроспективно проанализировали 40 пациентов, которым выполнили робот-ассистированную фундопликацию Toupet с крурорафией и дополнительной фиксацией манжетки к диафрагме [12]. Авторами описана одна конверсия доступа (2,5%), у 15% больных — развитие послеоперационных осложнений различной степени тяжести, включая один летальный исход вследствие интраоперационного ранения толстой кишки с последующим развитием перитонита. Через 11 мес были обследованы лишь 30% больных, у 1 диагностирован рецидив заболевания. Одним из самых крупных исследований является работа C. Galvani и соавт., включающая 61 наблюдение, проведенное за 2010—2015 гг., при этом всем пациентам выполняли пластику диафрагмы сетчатым эндопротезом [13]. Преобладали пациенты с кардиофундальны- ми (тип III, 64%), параэзофагеальными (тип II, 26%) и субтотальными (тип IV, 13%) ГПОД. Авторы сообщают об отсутствии летальных исходов и конверсий до- ступа, однако в раннем послеоперационном периоде наблюдались осложнения у 23% больных. В отдален- 10 ном периоде обследованы лишь 40 (60%) больных, при этом анатомический рецидив ГПОД диагностирован у 42%, из которых у 23% был рецидив симптомов гастро- эзофагеального рефлюкса. Описанные в мировой литературе неоднозначные результаты робот-ассистированных операций у больных с рефлюкс-эзофагитом и ГПОД во многом связаны с отсутствием единых алгоритмов лечения и крайне малым числом проведенных хирургических вмешательств у этой тяжелой категории больных. Дальнейшее накопление опыта и проведение сравнительных исследований помогут окончательно определить место и роль РХК у пациентов с ГПОД.
Заключение
Проведенные операции при больших и гигантских ГПОД позволили выявить явные технические преимущества РХК перед аналогичными лапароскопическими операциями: увеличенное 3D-изображение высокой четкости, изгибаемые инструменты с технологией EndoWrist позволили проводить прецизионную диссекцию тканей (грыжевого мешка, рубцовых сращений) в узком анатомическом пространстве (заднем средостении) без повреждения медиастинальной плевры, перикарда и блуждающих нервов. Отмечены также быстрота и легкость формирования интракорпоральных швов манжетки при использовании изгибаемых роботических иглодержателей. В то же время отсутствие этой технологии у гармонических ножниц (Harmonic Shears) не позволяло в полной мере использовать инструмент в ходе мобилизации во всех необходимых плоскостях, что было бы особенно ценным в заднем средостении. Использование для мобилизации изгибаемого роботизированного монополярного крючка позволяет устранить эти недостатки, но при этом крючок не обеспечивает адекватного гемостаза при пересечении коротких артерий и артерий малой кривизны желудка, кроме того, его использование затруднительно у пациентов с избыточной массой тела. Формирование антирефлюксной манжетки в условиях укорочения пищевода выполнение крурорафии выполнялись быстрее и технически проще при использовании РХК. Таким образом, проведенный нами ретроспективный анализ позволил сделать выводы о безопасности робот-ассистированных операций и целесообразности их выполнения преимущественно у больных с кардиофундальными, субтотальными и тотальными ГПОД. Считаем неоправданным использование РХК в хирургическом лечении пациентов с рефлюкс-эзофагитом и/или кардиальной ГПОД в связи с отсутствием доказанных преимуществ перед аналогичными лапароскопическими операциями.
Авторы заявляют об отсутствии конфликта интересов. The authors declare no conflicts of interest.