Робот-ассистированная полнослойная резекция при злокачественных опухолях мочевого пузыря
Резюме
Робот-ассистированная резекция мочевого пузыря (РАРМП) — terra incognita и камень преткновения в тактике лечения мышечно-инвазивного рака мочевого пузыря (МИРМП) — призвана обеспечить баланс онкологической радикальности и качества жизни пациентов с МИРМП, а ее значение в органосберегающем лечении требует изучения и оценки.
Цель исследования. Оценить результаты органосохраняющего хирургического лечения МИРМП при помощи роботизированной системы Da Vinci в условиях одного хирургического центра.
Материал и методы. Проанализирован опыт лечения 24 пациентов с МИРМП cT2a-bN0M0, степень анаплазии опухоли G1—2, которым в период 2012—2020 гг. была выполнена РАРМП. Средний возраст пациентов составил 63,8±6,2 года. Критериями включения являлись единичная опухоль мочевого пузыря при размерах, допускающих резекцию на расстоянии 2 см от опухоли, отсутствие регионарных и отдаленных метастазов, высоко- и умеренно-дифференцированная анаплазия опухоли. Операции производились в 3 этапа: I — уретроцистоскопия и стентирование мочеточников (по показаниям), II — РАРМП с чреспузырной трансиллюминацией, III — расширенная тазовая лимфаденэктомия. Конверсий, а также интраоперационных осложнений не наблюдалось.
Результаты. Продолжительность операции составила 151,2±20,6 мин, объем кровопотери — 89,3±27,9 мл. Нахождение в стационаре 9,7±2,9 койко/дня. Общехирургические осложнения по классификации Clavien—Dindo отмечены в 5,9% слу- чаев. Осложнения I степени, возникшие в 7% случаев, в исследование не включались. На основании результатов планового гистологического исследования положительный хирургический край не выявлен ни в одном случае. Медиана наблюдения составила 62,7±19,1 (диапозон 8—86) мес. За время наблюдения у 6 (25%) пациентов диагностирован рецидив РМП без инвазии в мышечный слой. Системное прогрессирование опухолевого процесса (отдаленное метастазирование) выявлено у 5 (20,8%) пациентов. Показатели 5-летней общей, опухолево-специфической и безрецидивной выживаемости составили 79,2, 91,6 и 45,8% соответственно.
Заключение. Роботический доступ является достойной альтернативой открытому при хирургическом лечении МИРМП, однако требует тщательного отбора пациентов. Преимуществом РАРМП является возможность достичь удовлетворительных функциональных и онкологических результатов при минимальной хирургической травме, что также позволяет сократить длительность пребывания пациентов в стационаре. РАРМП представляет собой оптимальный метод для использования в органосохраняющей хирургии рака мочевого пузыря.
В 2019 г. в Российской Федерации (РФ) стандартизированный показатель заболеваемости раком мочевого пузыря (РМП) был 6,29 случая на 100 000 населения. В структуре онкологической заболеваемости (оба пола) в РФ в 2019 г. РМП составил 2,7%, занимая 12-е место по рас- пространенности среди всех злокачественных новообразований (ЗНО) и 3-е место среди ЗНО мочевыделительной системы. В РФ число заболевших РМП в 2019 г. составило 13 314, тогда как в 2009 г. было выявлено 10 432 новых слу- чая, прирост заболеваемости за последние 10 лет составил 30,8%. Средний возраст пациентов с впервые выявленным РМП 67,5 года мало отличался от такового в 2009 г. (67 лет). В 2019 г. стандартизированный показатель смертности от РМП составил 1,99%. Средний возраст умерших 72 го- да (71,3 в 2009 г.) [1, 2]. Начальные стадии заболевания чаще всего протекают бессимптомно. Как правило, первым клиническим прояв- лением РМП становится безболевая гематурия. Дизурия, боль в нижних отделах живота или в поясничной области также должны обращать на себя внимание как потенциальные симптомы РМП [2].
Ультразвуковая диагностика является важным методом как в уточнении степени распространенности опухоли мочевого пузыря, так и на этапах динамического наблюдения. РМП чаще имеет вид экзофитного образования округлой или неправильной формы с неровной поверхностью, связанного со стенкой пузыря широким основанием, реже уз- кой ножкой. Иногда опухоль выглядит как уплощенное образование, широко связанное со стенкой пузыря и имеющее стелющийся вид. Эхогенность опухоли чаще высокая или средняя (сравнима с эхогенностью слизистого слоя). Как правило, применяют трансабдоминальное УЗИ. Ис- следование позволяет оценить расположение, размеры, структуру, характер роста, распространенность опухоли, а также определить емкость мочевого пузыря, деформацию стенок, характер роста опухоли и выход за пределы органа. Дуплексное сканирование позволяет лоцировать кровоток в структуре образования и определить степень его выраженности [3, 4]. Важно осмотреть и зоны регионарного метастазирования, верхние мочевыводящие пути, исключить наличие гидронефроза [2]. Значительно хуже при транс-абдоминальном исследовании выявляются опухоли, расположенные в области передней стенки, шейки мочевого пузыря и треугольника Льето, а также опухоли <5 мм диаметром [2, 5]. Чувствительность УЗИ в стадировании опухолевого процесса при T1 составляет 80,6%, при T2 — 91,2%, при T3—4 — 93,3% [5]. МСКТ является одним из актуальных методов визуализации РМП. Чувствительность метода достигает 80%, однако для выявления инвазивного компонента опухоли она невысока — до 35%. МСКТ значима преимущественно для исследования пораженных регионарных лимфатических узлов, при этом точность варьирует от 73 до 97%; в случае распространения процесса на соседние органы — до 87%; при выявлении опухолей в стадии T3a-b, когда есть возможность оценить толщину и плотность стенки мочевого пузыря, так как отсутствие четкости между наружным контуром стенки пузыря и паравезикальной клетчаткой является признаком внепузырной инфильтрации [5]. Оптимально быстрое сканирование выполняется на нефрографической фазе до того, как внутривенный контраст достигнет мочевого пузыря. Таким образом, накопившая контраст опухоль может быть визуализирована на фоне слабоконтрастированной мочи. При отсроченном сканировании поражение выглядит как образование на стенке мочевого пузыря на фоне контрастированной мочи. Образование может быть бляшкообразным или сосочковым. Также можно выявить кальцификацию: 5% переходно-клеточных карцином содержит кальцификаты на поверхности, имеющие узловую или дугообразную форму, 50% аденокарцином — мелкие внутриопухолевые кальцификаты. При оценке сканов только в аксиальной плоскости визуализация купола мочевого пузыря или его основания в некоторых случаях затруднена. Новые мультидетекторные компьютерные томографы с выбором тонких срезов и мультипланарной реконструкцией помогают в оценке этих областей [6, 7]. С появлением МСКТ-экскреторной урографии стало можно оценить не только уротелий, как при экскреторной урографии, но и прилегающие структуры [8].
Возможности многоплоскостной визуализации и высокий контраст тканей при МРТ привели к повышению точности стадирования по сравнению с МСКТ. Как и в случае с МСКТ, МРТ не всегда может отобразить глубину инвазии стенки мочевого пузыря, но она используется для определения стадии заболевания T3b и выше (когда опухоль распространяется за пределы мочевого пузыря). Использование T1-взвешенной последовательности особенно значимо для оценки распространения на паравезикальную клетчатку. На T2-взвешенном изображении опухоль имеет промежуточный сигнал, немного более высокий, чем сигнал стенки мочевого пузыря. У жира низкий сигнал, но может быть и высокий, если используются более быстрые последовательности, такие как быстрое спин-эхо. При МРТ ЗНО мочевого пузыря накапливает контрастное вещество. При этом пиковое усиление происходит раньше, чем у стенки мочевого пузыря. Коронарная и сагиттальная плоскости важны для диагностики перивезикальной инвазии, особенно в области купола и у основания мочевого пузыря [4, 9]. В 2018 г. для стандартизации визуализации и стадирования РМП с помощью мультипараметрической МРТ была создана система оценки VI-RADS, представленная 5-балльной шкалой VI-RADS [10]. Мышечно-инвазивное новообразование имеет худший прогноз и требует радикального хирургического вмешательства.
В настоящее время «золотым стандартом» диагностики, позволяющим верифицировать ЗНО мочевого пузыря, является цистоскопия с биопсией и морфологическим исследованием. В соответствии с актуальными клинически- ми рекомендациями это исследование должно быть про- ведено всем пациентам с симптомами РМП. При стадировании РМП используется классификация по системе TNM 8 (рис. 1) [11]. Стенка мочевого пузыря состоит из четырех слоев: слизистой оболочки, или уротелия, собственной пластинки, или субэпителиальной соединительной ткани, мышечного слоя и серозной оболочки, находящейся в области дна мочевого пузыря [12].
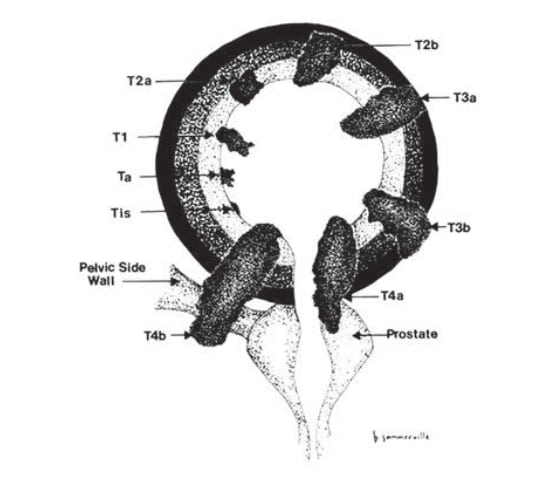 Рис. 1. Схематическое изображение TNM-стадий РМП [11]. / Fig. 1. Schematic sketch of TNM stages of bladder cancer [11].
Рис. 1. Схематическое изображение TNM-стадий РМП [11]. / Fig. 1. Schematic sketch of TNM stages of bladder cancer [11].
Особого внимания заслуживает рак дивертикула мочевого пузыря: в этом случае поражение характеризуется более агрессивным течением вследствие отсутствия мышечного слоя. Опухоли данной локализации имеют высокий потенциал метастазирования и соответственно более плохой прогноз. Встречаемость дивертикулов мочевого пузыря составляет 1,7% в детской популяции и 6% у взрослых. При этом частота развития неопластических изменений достигает 80% всех случаев дивертикулов, что, вероятно, связано с более длительным пребыванием канцерогенов и большей частотой развития инфекционных и воспалительных изменений в них [13, 14]. Отношение к выбору метода лечения, резекция или цистэктомия (ЦЭ) при мышечно-инвазивном раке мочевого пузыря (МИРМП), в настоящее время неоднозначное. Открытая радикальная ЦЭ с расширенной лимфаденэктомией является «золотым стандартом» для лечения пациентов с неметастатическим МИРМП (cT2-T4a, cN0-N1, М0), однако отличается высокой травматичностью: даже в центрах со значительным опытом выполнения ЦЭ частота осложнений достигает 58—77% в течение первых 30 дней, при этом частота повторных госпитализаций составляет 27% случаев [15]. Применение роботических систем имеет преимущество перед лапароскопической хирургией за счет значительно большей степени свободы инструментов, стабильного 3D-изображения высокого разрешения, более комфортных условий работы для хирурга. Робот-ассистированный доступ при ЦЭ все чаще обсуждается как альтернатива открытому доступу [16].
Ранний опыт выполнения резекций мочевого пузыря до начала 1990-х годов был отмечен частыми рецидивами, в частности в послеоперационном шве и низкой общей выживаемостью (ОВ). В этот период частота рецидивов достигала 78% [17, 18], причем рецидивом неинвазивного рака являлись 35% из них, МИРМП — 50% [19]. В 2000-х годах специалисты Memorial Sloan Kettering Cancer Center (MSKCC) и MD Anderson создали более жесткие критерии отбора кандидатов на органосберегающее лечение пациентов с первичным МИРМП: опухоль должна быть одиночной, с возможностью отступа 2 см от здоровой (интактной) ткани и адекватным объемом мочевого пузыря после резекции, при этом пузырь должен быть не леченным ранее по поводу рака, а также должна сохраняться возможность реимплантации мочеточника [20, 21]. Столь жестким критериям соответствовали только 3—5% пациентов с МИРМП, однако тщательный отбор позволил снизить частоту рецидивирования до 41% [20—22
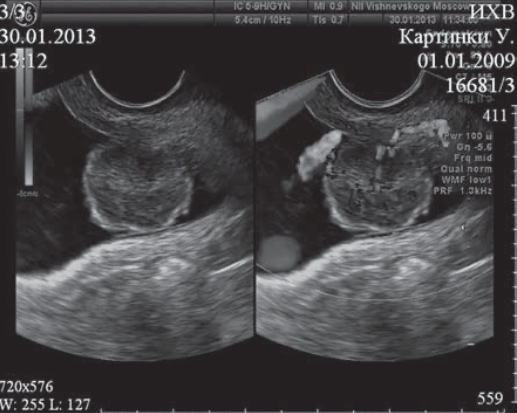 Рис. 2. УЗ-изображения опухоли мочевого пузыря (слева в B-режиме, справа в режиме цветового допплеровского картирования). Fig. 2. Ultrasound images of the bladder tumor (B-mode (left), color Doppler mode (right)).
Рис. 2. УЗ-изображения опухоли мочевого пузыря (слева в B-режиме, справа в режиме цветового допплеровского картирования). Fig. 2. Ultrasound images of the bladder tumor (B-mode (left), color Doppler mode (right)).
Появление лапароскопической хирургии стало малоинвазивной альтернативой традиционным открытым методам хирургического вмешательства. Снижение объема интраоперационной кровопотери, длительности госпитализации, короткий реабилитационный период делают лапароскопическую урологическую хирургию востребованной, несмотря на то, что данный вид техники требует дополнительных навыков от оперирующих хирургов [23]. В Weill Cornell Medical College Нью-Йоркской пресвитерианской больницы ретроспективно проанализировали данные 29 пациентов, которые подверглись робот-ассистированной резекции мочевого пузыря (РАРМП) по поводу первичного МИРМП в период с 2005 по 2015 г. Средний объем кровопотери составил 50 мл, в среднем продолжительность пребывания в реанимации — 1 койко/день. Ранние (в течение 30 дней) осложнения в послеоперационном периоде имели 2 (6,9%) пациента, поздние послеоперационные осложнения (в течение 90 дней) наблюдались у 5 (17,9%), все они представлены Clavien—Dindo I. Положительный хирургический край (ПХК) выявлен у 3,6% пациентов с МИРМП, было удалено до 12 лимфатических узлов. Ни размер, ни локализация опухоли в дивертикуле, ни необходимость реимплантации мочеточников не были предиктором кровотечения и увеличения продолжительности госпитализации. Роботизированный подход не повлиял на онкологические результаты. Показатели 5-летней ОВ и безрецидивной выживаемости (БРВ) составили 79 и 68% соответственно [24]. В то же время ЦЭ характеризуются крайне низким ка- чеством жизни пациентов в послеоперационном периоде, невзирая на различные варианты деривации мочи. Высокая травматичность операции и технические сложности ее выполнения делают ЦЭ для ряда пациентов с РМП невозмож- ной, поэтому органосохраняющее лечение все чаще используется как для открытых, так и для малоинвазивных хирурги- ческих вмешательств. Органосохраняющие операции в виде полнослойных резекций шейки мочевого пузыря с использованием роботического комплекса являются операцией выбора при МИРМП и феохромоцитоме, так как позволяют радикально удалить опухоль, резецировать устье мочеточника (интрамуральный отдел мочеточника) с одномоментной пластикой устья мочеточника на стенте, выполнить подвздошно-обтураторную лимфаденэктомию, сохранить в большем объеме детрузор по сравнению с открытой резекцией [25]. Основные цели сохранения мочевого пузыря при МИРМП — улучшить качество жизни и избежать тяжелых осложнений без ущерба для онкологических результатов. Из-за отсутствия завершенного рандомизированного контролируемого исследования онкологическая эквивалентность методов лечения с сохранением мочевого пузыря по сравнению с ЦЭ остается неизвестной [26]. Цель исследования — оценить результаты органосохраняющего хирургического лечения МИРМП при помощи роботизированной системы Da Vinci.
Материал и методы
В ФГБУ «НМИЦ хирургии им. А.В. Вишневского» Минздрава РФ в период с 2012 по 2020 г. проходили лечение 24 пациента с МИРМП при стадии заболевания по классификации TNMpT2a-bN0M0, G1—2 степени анаплазии. Всем пациентам выполнили хирургическое лечение в объеме РАРМП. Критерии включения в исследование: одиночные опухоли мочевого пузыря, локализованные в шейке мочевого пузыря, а также вблизи устья одного из мочеточников при инвазии опухоли в пределах мышечного слоя T2a-b, степень дифференцировки (анаплазии) G 1—2, отсутствие регионарного метастазирования, поражения простатического отдела уретры. Carcinoma in situ также являлась критерием исключения. Большинство пациентов были мужчины — 19 (79,2%). Средний возраст составил 63,8±6,2 года. В исследование вошли пациенты со 2-й стадией заболевания по системе TNM: T2a — 13 (54,1%), T2b — 10 (41,7%), в 1 (4,2%) случае верифицирована феохромоцитома. На основании УЗИ (рис. 2), МСКТ или МРТ оценивали основные параметры опухоли (рис. 3). По данным УЗИ и МСКТ органов брюшной полости, односторонний вторичный гидронефроз выявлен у 5 (20,8%) пациентов, двустороннего поражения не выявлено. Всем пациентам выполнили хирургическое лечение в объеме РАРМП. Основные клинические параметры пациентов, подвергшихся хирургическому лечению, представлены в табл. 1. Хирургическое вмешательство выполнялось в три этапа:
- I этап — уретроцистоскопия и стентирование мочеточников. Пациент укладывался в литотомическое положение, выполнялась общая эндотрахеальная анестезия. Затем цистоскопом с рабочим каналом выполнялись уретроцистоскопия, стентирование обоих мочеточников по стандартной методике;
- II этап — РАРМП с чреспузырной трансиллюминацией. Операция производилась тремя манипуляторами с использованием биполярного зажима, монополярных ножниц, одноокончатого зажима и иглодержателя.
Доступ производился через установленные 4 порта: No12 в зоне пупка и в правой и левой подвздошных областях. Осуществлялась мобилизация мочевого пузыря. Визуально оценивались его состояние, форма, плотность стенок, расположение, степень распространенности опухоли, а также степень вовлеченности в онкологический процесс мочеточников. Опираясь на трансиллюминационное свечение цистоскопа, с помощью биполярной коагуляции циркулярно резецировался сегмент мочевого пузыря с опухолевым образованием (рис. 4). В случае локализации опухоли в области устья мочеточника производилась ее резекция с формированием уретероцистанастомоза (рис. 5). Выделялся пораженный опухолью мочеточник на протяжении нижней трети. Монополярными ножницами рассекалась стенка мочевого пузыря по дистальному контуру предполагаемого лоскута. Производился гемостаз.
Таблица 1. Клинические параметры пациентов, подвергшихся хирургическому лечению по поводу МИРМП/ Table 1. Clinical parameters in patients undergoing surgical treatment for MIBC
| Критерий | Показатель |
|---|---|
| Число больных | 24 |
| Пол, абс. (%): женский | 5 (20,8) |
| Пол, абс. (%): мужской | 19 (79,2) |
| Возраст, годы | 63,8±6,2 |
| Патологическая стадия, абс. (%): Т2а | 13 (54,1) |
| Патологическая стадия, абс. (%): Т2b | 10 (41,7) |
| Патологическая стадия, абс. (%): феохромоцитома | 1 (4,2) |
| Гидронефроз, абс. (%): нет | 19 (79,2) |
| Гидронефроз, абс. (%): односторонний | 5 (20,8) |
| Гидронефроз, абс. (%): двусторонний | - |
| Гистологический тип, абс. (%): уротелиальный рак | 19 (79,2) |
| Гистологический тип, абс. (%): плоскоклеточная карцинома | 2 (8,3) |
| Гистологический тип, абс. (%): аденокарцинома | 2 (8,3) |
| Гистологический тип, абс. (%): феохромоцитома | 1 (4,2) |
На стенку мочевого пузыря дистальнее основания лоскута накладывали швы синтетической рассасывающейся нитью 3-0, подтягивая мочевой пузырь к сухожилию поясничной мышцы. Во всех случаях следует избегать натяжения мочеточника. Для формирования подслизистого туннеля достаточной длины располагали лоскут мочевого пузыря и мочеточник «внахлест» не менее чем на 3 см. Если этого не удавалось добиться, дополнительно мобилизовали мочеточник с сохранением его адвентиции. При недостаточной длине мочеточника туннель не формировали, конец мочеточника сшивали с краем мочепузырного лоскута. Лоскут ушивали в виде трубки непрерывным швом нитью 4-0, не захватывая слизистую оболочку, таким же образом закрывали дефект стенки мочевого пузыря. Вторым рядом узловых швов синтетической рассасывающейся нитью 4-0 сшивали адвентицию и мышечный слой стенки мочевого пузыря. Несколькими дополнительными швами соединяли конец мочепузырного лоскута с адвентицией мочеточника, формировали слизисто-мышечную манжету. Производили пластику мочевого пузыря трехрядным швом. С целью контроля гидростаза через уретральный катетер вводили физиологический раствор; III этап — подвздошно-обтураторная лимфаденэктомия. С обеих сторон выделяли подвздошные сосуды до области бифуркации аорты. С использованием биполярной коагуляции удаляли клетчатку и лимфатические узлы (рис. 6). Во время проведения хирургического вмешательства интраоперационных осложнений и конверсий не было.
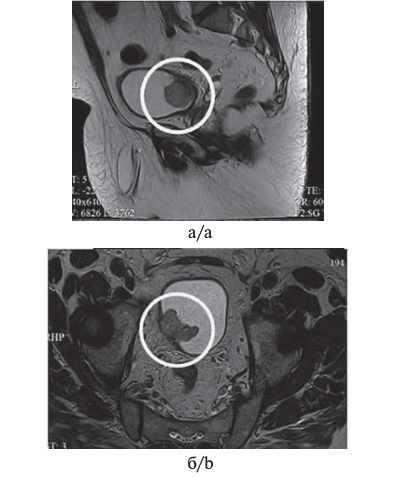 Рис. 3. МР-изображение органов малого таза. На правой боковой стенке мочевого пузыря инвазивная опухоль (выделена кругом) смешанного строения до 4 см в диаметре: сагиттальная проекция (а), аксиальная проекция (б). / Fig. 3. MP image of the pelvic organs. The right lateral bladder wall shows an invasive tumor (circle) of mixed structure up to 4 cm in diameter: sagittal projection (a), axial projection (b).
Рис. 3. МР-изображение органов малого таза. На правой боковой стенке мочевого пузыря инвазивная опухоль (выделена кругом) смешанного строения до 4 см в диаметре: сагиттальная проекция (а), аксиальная проекция (б). / Fig. 3. MP image of the pelvic organs. The right lateral bladder wall shows an invasive tumor (circle) of mixed structure up to 4 cm in diameter: sagittal projection (a), axial projection (b).
Результаты и обсуждение
Медиана продолжительности операций составила 151,2±20,6 мин. Медиана объема интраоперационной кровопотери — 89,3±27,9 мл. На основании результатов планового гистологического исследования ПХК не выявили ни в одном случае. Общехирургические осложнения по классификации Clavien—Dindo наблюдались в 3 (12,5%) случаях. Средняя длительность пребывания в стационаре была 9,7±2,9 койко/дня. Медиана наблюдения составила 62,7±19,1 (при диапазоне 8—86) мес. За время наблюдения у 6 (25%) пациентов диагностирован рецидив РМП без инвазии в мышечный слой. Системное прогрессирование опухолевого процесса (отдаленное метастазирование) выявлено у 5 (20,8%) пациентов. Показатели 5-летней ОВ, опухолево-специфической выживаемости (ОСВ), БРВ составили 79,2, 91,6 и 45,8% соответственно. В табл. 2 представлены основные характеристики результатов хирургического лечения пациентов с МИРМП, подвергшихся РАРМП. Поскольку заболеваемость РМП продолжает расти в РФ и во всем мире, роботизированная хирургия привлекает внимание как потенциальный вариант лечения селективных групп пациентов с МИРМП. По мере увеличения хирургического опыта постепенно внедряется РАРМП, что дает потенциальные преимущества, включая снижение объема кровопотери, уменьшение боли в послеоперационном периоде и меньшее количество анастомотических стриктур (за счет большей прецизионности шва), что в свою очередь ведет к снижению послеоперационного койко/дня [1].
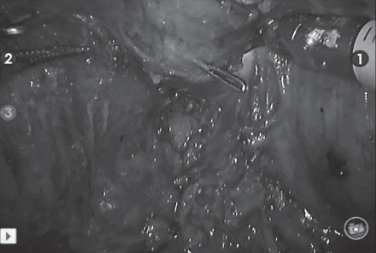
Рис. 4. Чреспузырная трансиллюминация. 1 — ножницы , 2 — биполярный коагулятор Fig. 4. Transvesical transillumination. 1 — scissors; 2 — a bipolar coagulator.
 Рис. 5. Формирование уретероцистанастомоза. 1 — иглодержатель, 2 — биполярный коагулятор. Fig. 5. Ureterocystanastomosis. 1 — a needleholder; 2 — a bipolar coagulator.
Рис. 5. Формирование уретероцистанастомоза. 1 — иглодержатель, 2 — биполярный коагулятор. Fig. 5. Ureterocystanastomosis. 1 — a needleholder; 2 — a bipolar coagulator.
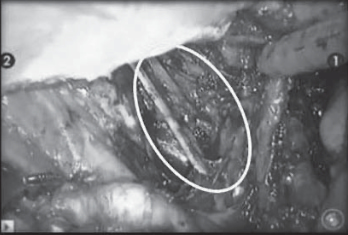 Рис. 6. Подвздошно-обтураторная лимфаденэктомия. 1 — роботический инструмент, кругом выделен запирательный нерв. Fig. 6. Iliac and obturator lymphadenectomy. 1 — a robotic instrument; 2 — obturator nerve (circle).
Рис. 6. Подвздошно-обтураторная лимфаденэктомия. 1 — роботический инструмент, кругом выделен запирательный нерв. Fig. 6. Iliac and obturator lymphadenectomy. 1 — a robotic instrument; 2 — obturator nerve (circle).
Таблица 2. Основные характеристики результатов хирургического лечения пациентов с МИРМП, подвергшихся РАРМП Table 2. The main characteristics of the results of surgical treatment in MIBC patients undergoing RAC
| Критерий | Показатель |
|---|---|
| Медиана продолжительности операции, мин | 151,2±20,6 |
| Медиана объема интраоперационной кровопотери, мл | 89,3±27,9 |
| Средний койко/день | 9,7±2,9 |
| Осложнения, абс (%) | 3 (12,5%) |
| Медиана времени наблюдения, мес | 62,7±19,1 |
| Пятилетняя ОСВ, % | 91,6 |
| Пятилетняя ОВ, % | 79,2 |
| Пятилетняя БРВ, % | 45,8 |
С целью снижения травматичности хирургического лечения РМП в 1993 г. был предложен минимально инвазивный подход к резекции мочевого пузыря. G. Ferzli и соавт. [26] сообщили о первом случае лапароскопической резекции мочевого пузыря (ЛРМП) у пациентки, таким образом, установив возможность использования малоинвазивного подхода. M. Mariano и соавт. [27] сообщили о 6 случаях ЛРМП по поводу МИРМП: при медиане наблюдения 30 мес выявлен 1 (17%) рецидив. Jr. Colombo и соавт. [28] в серии своих статей о ЛРМП дополнительно подтвердили безопасность метода, но подчеркнули, что технические требования данного вмешательства могут быть ограничены критериями локализации опухоли. В 2008 г. B. Tareen и соавт. и S. Allaparthi и соавт. [29, 30] успешно продемонстрировали применение роботизированного подхода для резекции мочевого пузыря на малой выборке пациентов.
A. Sood и соавт. [31] выполнили РАРМП 7 пациентам, данное вмешательство было модифицировано и позволяло проводить интраоперационную оценку хирургического края. При среднем сроке наблюдения 38,9 мес специалистам удалось доказать, что «модифицированный» метод РАРМП технически осуществим, безопасен и воспроизводим; кроме того, РАРМП приводит к благоприятным онкологическим и функциональным результатам у пациентов, которым была выполнена резекция мочевого пузыря. Хотелось бы акцентировать внимание на допустимости органосберегающего лечения пациентов с МИРМП: в соответствии с современной парадигмой лечения этого заболевания тщательно отобранные пациенты с МИРМП не нуждаются в выполнении ЦЭ и в то же время демонстрируют благоприятные онкологические результаты. Органосберегающий подход позволяет избежать осложнений, характерных для ЦЭ, в частности сохранить функцию мочевого пузыря, а у мужчин — сексуальную функцию. Согласно исследованию J. Stein и соавт., 2006 г., ранние осложнения после ЦЭ возникают у 28% пациентов [32, 33]. Особенности отведения мочи при ЦЭ имеют множество последствий, отмечаются в первую очередь психологические, косметические и метаболические нарушения. Гиперхлоремический ацидоз — одно из хорошо известных метаболических осложнений некоторых видов деривации мочи — весьма опасен. РАРМП может быть методом выбора для пациентов с МИРМП с низким соматическим статусом для проведения ЦЭ, например пожилым пациентам и пациентам с отягощенным соматическим статусом [34].
Роботизированная хирургия имеет явные преимущества перед лапаротомией или лапароскопией, при этом обеспечивает лучшую маневренность и визуализацию области операции, что особенно важно для выявления точных границ опухоли, а также положительно влияет на качество интракорпоральных швов [34, 35]. Пациенты, перенесшие РАРМП, демонстрируют лучшие показатели качества жизни, раннюю активизацию и более низкую потребность в наркотических анальгетиках, чем пациенты, перенесшие РМП из стандартного доступа [36]. По данным исследований последних лет, частота послеоперационных осложнений выше у пациентов, перенесших открытую резекцию, чем у пациентов, перенесших РАРМП. Пациенты, перенесшие открытую резекцию мочевого пузыря, чаще страдали от ранних респираторных осложнений. Это может быть связано с уменьшением боли в когорте роботических операций, что позволяет раньше провести респираторную реабилитацию. Очевидно, снижение объема интраоперационной кровопотери, связанной с роботизированной хирургией, также значимо в уменьшении послеоперационных осложнений [37].
Прямое сравнение нашего опыта с предыдущими данными затруднено из-за редко используемой хирургической техники при этом заболевании и малой когорты пациентов, представленной в данной статье. Однако при сравнении наших результатов с аналогичными исследованиями находим сопоставимые данные онкологических и функциональных результатов. Таким образом, можно сказать, что РАРМП при МИРМП является безопасным и технически осуществимым вариантом лечения у пациентов с инвазивным раком мочевого пузыря.
Заключение
В настоящее время в РФ органосохраняющее лечение, в том числе с применением роботических технологий, при МИРМП проводится в единичных случаях. В мире данные операции применяются преимущественно при дивертикулах мочевого пузыря и в основном при лапароскопическом доступе. Методика РАРМП при злокачественных опухолях с поражением шейки мочевого пузыря расценивается как надежная и менее травматичная альтернатива стандартным хирургическим пособиям. При этом достигается лучший функциональный результат, что позволяет применять эту методику при МИРМП с удовлетворительными функциональными результатами. РАРМП представляет собой альтернативный вариант доступа при хирургическом лечении МИРМП, но требует тщательной селекции пациентов и последующего длительного наблюдения. Мы продемонстрировали, что РАРМП не только является оправданным вариантом лечения для определенных групп пациентов, но и позволяет достичь удовлетворительных онкологических и функциональных результатов.
Авторы заявляют об отсутствии конфликта интересов. The authors declare no conflicts of interest.







