Реконструкция опорно-связочного аппарата малого таза при робот-ассистированной радикальной простатэктомии как этап кривой обучения
Цель исследования – оценить результаты робот-ассистированной лапароскопической радикальной простатэктомии в рамках кривой обучения одного хирурга; оценить влияние реконструкции опорно-связочного аппарата малого таза на раннее восстановление удержания мочи.
Материалы и методы
В зависимости от даты операции 246 пациентов разделены на 3 группы. Анализируемые данные собирались проспективно и ретроспективно. Оценивались предоперационные показатели (стадияпоTNM, ISUP, простатический специфический антиген), интраоперационные показатели (длительность операции, объем кровопотери, вид и характер операции, тип реконструкции опорно-связочного аппарата малого таза) и послеоперационные показатели (длительность дренирования мочевого пузыря уретральным катетером, степень и сроки восстановления удержания мочи и эректильной функции). Реконструкции опорно-связочного аппарата малого таза осуществлялись путем восстановления фасции Денонвилье (шов Рокко), а также путем сшивания мышечных волокон шейки мочевого пузыря с периуретральными тканями и остатками пубопростатических связок для стабилизации таким образом уретровезикального комплекса.
Результаты
Все операции были успешно завершены без конверсий или переливаний. Медиана длительности операции составила 160 мин (p = 0,0001). Медиана кровопотери составила 173,3 см3 (p = 0,0002). Средний объем предстательной железы – 36 см3 (29–47,5 см3), а общая частота положительного хирургического края составила 12,82 %. Общая частота восстановления удержания мочи: 51,6 % – через 3 мес, 63,7 % – через 6 мес (p >0,05). В группе пациентов с реконструкцией опорно-связочного аппарата малого таза частота восстановления удержания была выше по сравнению с группой без реконструкции: 64,1 % vs 45,3 % (через 3 мес, р = 0,041) и 74,7 % vs 62,3 % (через 6 мес, р = 0,034).
Заключение
Время операции, объем кровопотери значительно снизились с увеличением количества про- веденных оперативных пособий. Отмечено значимое улучшение показателей раннего восстановления удержания мочи в группе с выполнением реконструкции опорно-связочного аппарата малого таза.
Введение
Рак предстательной железы (РПЖ) является 2-м по распространенности видом рака среди мужского населения, а по смертности среди онкологических заболеваний занимает 5-е место [1]. Радикальная простатэктомия (РПЭ) является стандартным методом хирургического лечения местно-распространенного РПЖ [2]. Традиционно эта операция выполняется через открытый позадилонный доступ и чаще всего сопровождается значительной кровопотерей, требует дополнительного обезболивания и увеличения сроков нахождения пациента в стационаре [3]. В настоящее время повсеместно применяются малоинвазивные подходы, такие как лапароскопическая РПЭ и робот-ассистированная лапароскопическая радикальная простатэктомия (РАРП), позволяющие уменьшить сроки госпитализации и вероятность развития осложнений. В Европе и США РАРП стала самым частым хирургическим пособием при РПЖ, вытесняя позадилонную РПЭ, которая до последнего времени являлась «золотым стандартом» хирургического лечения локализированного и местно-распространенного РПЖ [2]. РАРП стала ведущим методом лечения РПЖ, по своим клиническим результатам превосходя позадилонную и лапароскопическую РПЭ. Однако в развивающихся странах с ограниченным бюджетом и стратегией рационального распределения ресурсов здравоохранения доступность робот-ассистированных технологий низка, так как требует больших прямых затрат на оборудование и обучение [4]. Одной из главных причин популярности РАРП является короткая кривая обучения. Хирурги, не имеющие большого опыта использования лапароскопических методик, выполняя минимально инвазивную простатэктомию с помощью робота, достигают оптимальных результатов на более ранних сроках обучения, чем при использовании лапароскопической техники [5]. Однако для достижения адекватных функциональных результатов и уменьшения частоты отрицательного хирургического края необходимо боль- шее количество случаев [6]. На скорость освоения хирургической техники выполнения РАРП влияет множество факторов, среди которых исходные хирургические навыки врача, тип программы обучения и личный опыт выполнения лапароскопических операций [7, 8]. Для достижения более коротких сроков полного восстановления удержания мочи хирурги применяют различные методики восстановления опорно-связочного аппарата малого таза у мужчин при выполнении уретровезикального анастомоза. Данные методики (задняя реконструкция по Рокко, передняя реконструкция или передняя суспензия) стабилизируют уретровезикальный комплекс и тем самым влияют на сроки восстановления удержания мочи [9]. В нашем исследовании мы хотим выяснить, какова будет скорость освоения РАРП хирургом с большим опытом лапароскопической РПЭ, как будет меняться хирургическая техника и отразится ли это на сроках восстановления удержания мочи.
Цель настоящего исследования – оценить результаты РАРП в рамках кривой обучения одного хирурга; оценить влияние реконструкции опорно-связочного аппарата малого таза на раннее восстановление удержания мочи.
Материалы и методы
Было проведено ретроспективное исследование, объектом которого стали 246 пациентов с морфологически верифицированным РПЖ. Данным пациентам за период с июня 2015 г. по сентябрь 2019 г. одним хирургом выполнялась РАРП на роботической системе «Да Винчи Си» (da Vinci Si) компании Intuitive Surgical (США) (рис. 1). Данные были собраны ретроспективно, все пациенты были поделены на 3 равные группы (по 82 пациента) в зависимости от даты операции.
 Рис. 1. Операция с помощью хирургической системы «Да Винчи Си»/ Fig. 1. Surgery using the da Vinci Si surgical system
Рис. 1. Операция с помощью хирургической системы «Да Винчи Си»/ Fig. 1. Surgery using the da Vinci Si surgical system
Использовалась стандартная трансперитонеальная техника выполнения РАРП. Решение о выполнении тазовой лимфаденэктомии принималось исходя из вероятности поражения лимфатических узлов по данным номограмм РООУ и Бриганти [10]. Нервосбережениe проводилось в случае локализированного РПЖ низкого онкологического риска по классификации D’Amico и сохраненной сексуальной функции пациента (более 17 баллов по шкале международного индекса эректильной функции (МИЭФ-5)). Послеоперационный уровень общего простатического специфического антигена (ПСА), а также качество удержания мочи регистрировались каждые 3 мес после операции. Биохимический рецидив, согласно рекомендациям, считался в случае превышения уровня общего ПСА выше 0,2 нг/мл, следующего за 2-м подтверждающим уровнем [11]. Как показала практика, пациенты не всегда корректно отвечают на вопросы опросников, оценивающие функцию удержания мочи. Поэтому полное восстановление удержания мочи определяли как отсутствие необходимости пользоваться прокладками или использование 1 страховочной прокладки. Состояние эректильной функции оценивалось через 6 мес и далее в соответствии со шкалой МИЭФ-5, а также по объективной способности пациента к половому акту как без медикаментозной поддержки, так и с применением ИФДЭ-5. Начальные результаты включали: время операции (в мин), положительный хирургический край (ПХК), объем кровопотери, длительность катетеризации мочевого пузыря, изменение степени раннего восстановления удержания мочи и половой функции по мере повышения хирургом собственного опыта. Клинические характеристики пациентов пред- ставлены в табл. 1.
Статистический анализ выполнялся с помощью программного пакета IBM SPSS Statistics, версия 23. Статистически значимыми считались различия p <0,05.
Таблица 1. Исходные клинические характеристики пациентов/ Table 1. Baseline patient characteristics
| Показатель/Parameter | Всего Total (n = 246) | 1-я группа 1st group (n = 82) | 2-я группа 2nd group (n = 82) | 3-я группа 3rd group (n = 82) | р |
|---|---|---|---|---|---|
| Возраст, лет Age, years Среднее ± СО Mean ± SD Медиана Median | 62,23 ± 7,07 62,0 |
62,35 ± 6,94 62,5 |
62,02 ± 7,04 62,0 |
62,32 ± 6,96 62,0 |
0,45 |
| ИМТ, кг/м2 BMI, kg/m2 Среднее ± СО Mean ± SD Медиана Median | 27,80 ± 4,06 27,3 |
26,95 ± 4,12 27,1 |
27,96 ± 3,46 27,0 |
28,51 ± 4,45 27,8 |
0,26 |
| ПСА, нг/мл PSA, ng/ml Среднее ± СО Mean ± SD Медиана Median | 9,56 ± 7,49 7,50 |
8,68 ± 5,96 7,18 |
9,57 ± 7,47 7,26 |
10,43 ± 8,77 8,30 |
0,47 |
| Объем предстательной железы, см3 Prostatic volume, cm3 Среднее ± СО Mean ± SD Медиана Median | 43,24 ± 21,86 40,0 |
39,98 ± 19,26 33,5 |
39,98 ± 15,02 40,00 | 49,78 ± 28,07 43,5 |
0,59 |
| Клиническая стадия, n (%) Clinical stage, n (%) сТ1 сТ2 сТ3 |
165 (67,1) 50 (20,3) 31 (12,6) |
52 (68,3) 23 (28,0) 7 (8,5) |
61 (74,4) 15 (18,3) 9 (7,3) |
61 (74,4) 6 (7,3) 15 (18,3) |
0,52 |
| Группа по ISUP, n (%) ISUP group, n (%) 1 2 3 4 5 |
134 (54,7) 77 (31,4) 16 (6,5) 11 (4,5) 7 (2,9) |
55 (67,1) 24 (29,3) 2 (2,4) 1 (1,2) 0 (0)* |
43 (52,4)* 26 (31,7) 4 (4,9) 6 (7,3) 3 (3,7) |
36 (44,4)* 27 (33,3) 10 (12,3)* 4 (4,9) 4 (4,9) |
0,029 |
| Риск по D’Аmico, n (%) D’Аmico risk, n (%) Низкий Low Умеренный Moderate Высокий High |
108 (43,9) 83 (33,7) 55 (22,4) |
53 (64,6) 17 (20,7) 12 (14,6) |
31 (37,8) 31 (37,8) 20 (24,4) |
24 (29,3) 35 (42,7) 23 (28,0) |
0,005 |
| Процент поражения лимфоузлов по Briganti, n (%) Percentage of lymph node involvement per Briganti, n (%) <5 % ≥5 % |
157 (63,8) 89 (36,2) |
55 (67,1) 27 (32,9) |
52 (63,4) 30 (36,6) |
50 (61,0) 32 (39,0) |
0,33 |
Результаты
Статистически достоверных различий между группами по возрасту, индексу массы тела, сумме баллов по шкале МИЭФ-5, уровню ПСА, объему предстатель- ной железы, группе по ISUP, клинической стадии, вероятности поражения лимфатических узлов по данным Briganti не выявлено (см. табл. 1). Медиана срока наблюдения всех пациентов составила 18 мес. Средний возраст пациентов составил 62,23 ± 7,07 года. Средний уровень общего ПСА – 9,56 ± 7,49 нг/мл. По классификации прогностических факторов D’Amico пациенты распределились на категории низкого (43,9 %), умеренного (33,7 %) и высокого (22,4 %) риска. Среди пациентов с низким риском отличались 1-я и 3-я, 2-я и 3-я группы (64,6 и 29,3 %; 37,8 и 29,3 % соответственно) (р = 0,005). Таким образом, в 3-й группе доля пациентов с высоким онкологическим риском по сравнению с 1-й и 2-й группами была значительно выше (рис. 2).
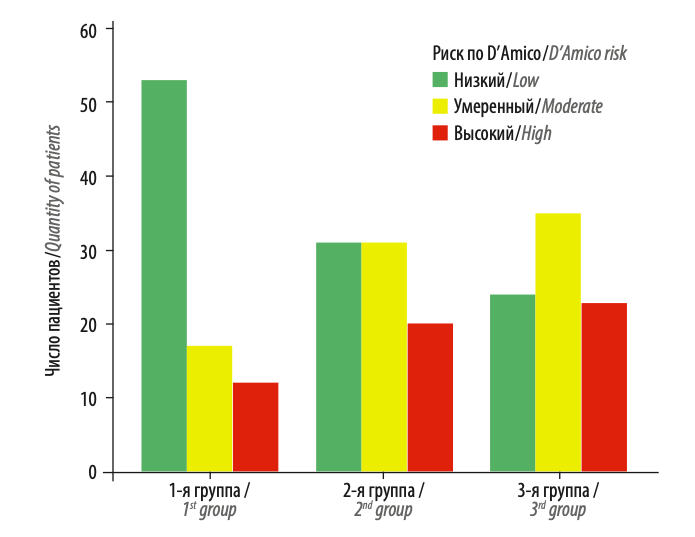 Рис. 2. Распределение пациентов согласно онкологическому риску по D’Amico среди групп Fig. 2. Distribution of patients according to cancer risk by D'Amico among groups
Рис. 2. Распределение пациентов согласно онкологическому риску по D’Amico среди групп Fig. 2. Distribution of patients according to cancer risk by D'Amico among groups
Медиана времени операции составила 160 мин. Время учитывалось от разреза до конца ушивания раны, включая время на докинг. Длительность операции существенно снизилась от группы 1 к группе 3 (р = 0,0001) (табл. 2, рис. 3).
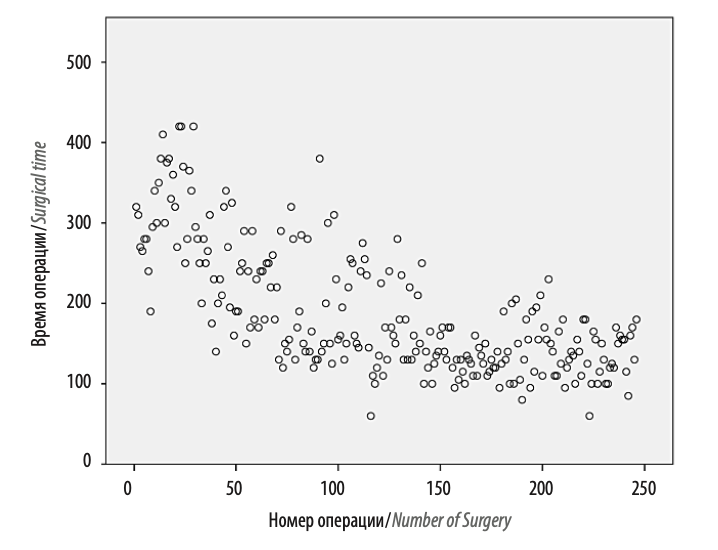 Рис. 3. Кривая обучения для длительности операции Fig. 3. Learning curve for surgical time
Рис. 3. Кривая обучения для длительности операции Fig. 3. Learning curve for surgical time
Ни одному пациенту не выполнялась конверсия. Средний объем кровопотери составил 173,35 мл. По мере приобретения опыта хирургом объем кровопотери значимо уменьшался (р = 0,0002). Ни один пациент не нуждался в переливании крови. Отмечается снижение частоты нервосберегающих РАРП с приобретением хирургом опыта и увеличение частоты тазовой лимфаденэктомии (24 % – в 1-й группе и 35 % – в 3-й) (табл. 3). Данные отличия между группами соотносятся со степенью онкологического риска по D’Amico (в 1-й группе превалируют пациенты низкого онкологического риска, в 3-й – умеренного и высокого онкологического риска).
Таблица 2. Периоперационные клинические характеристики групп/ Table 2. Groups’ perioperative clinical characteristics
| Показатель/Parameter | Всего Total (n = 246) |
1-я группа 1st group |
2-я группа 2nd group |
3-я группа 3rd group |
р |
|---|---|---|---|---|---|
| Время операции, мин Surgical time, min Среднее ± СО Mean ± SD Медиана Median |
188,61 ± 77,97 160 |
260,30 ± 75,53 262,5 |
166,59 ± 58,11 150 |
138,33 ± 31,97 130 |
0,0001 |
| Объем кровопотери, мл Blood loss volume, ml Среднее ± СО Mean ± SD Медиана Median |
173,35 ± 150,96 100 |
257,56 ± 202,17 200 |
125,31 ± 87,01 100 |
136,59 ± 97,19 100 |
0,0002 |
| Длительность дренирования мочевого пузыря уретральным катетером, дни Duration of bladder draining with a urethral catheter, days Среднее ± СО Mean ± SD Медиана Median |
7,15 ± 3,36 7 |
8,66 ± 4,59 7 |
6,74 ± 2,24 6 |
5,81 ± 1,46 6 |
0,005 |
Примечание. СО – стандартное отклонение; p – уровень значимости различий. Note. SD – standard deviation; p – significance level.
Неотъемлемой частью прохождения хирургом кривой обучения РАРП является освоение хирургических техник, направленных на более раннее восстановление удержания мочи. Речь идет о следующих хирургических техниках: максимальное сохранение опорно-связочного аппарата малого таза, максимальное сохранение длины мембранозной части уретры, задняя реконструкция по Рокко, передняя реконструкция. Реконструкция опорно-связочного аппарата малого таза осуществлялась путем выполнения задней и передней реконструкции. Задняя реконструкция выполнялась путем восстановления фасции Денонвилье (шов Рокко, Rocco stitch). После формирования непрерывного уретровезикального анастомоза выполнялась передняя реконструкция путем сшивания мышечных волокон шейки мочевого пузыря с периуретральными тканями и остатками пубопростатических связок с формированием таким образом искусственных пубовезикальных связок. Данная техника играет важную роль в стабилизации уретровезикального комплекса и способствует раннему восстановлению удержания мочи в послеоперационном периоде.
В случае низкого/умеренного онкологического риска по D’Amico пациентам выполнялась РАРП без рассечения эндопельвикальной фасции. Дорсальный венозный комплекс пересекался ближе к шейке мочевого пузыря, что позволило сохранить целостность лоннопростатических связок. Этап апикальной диссекции с приобретением опыта также претерпел изменения в сторону диссекции без использования электрохирургии с максимальным сохранением длины мембранозного отдела уретры. Задняя реконструкция по Рокко выполнялась или путем ушивания остатков ректоуретральной мышцы к остаткам фасции Денонвилье (в случае экстрафасциальной диссекции), или путем формирования дубликатуры фасции Денонвилье в случае ее полного сохранения (интра- и интерфасциальной диссекции). Передняя реконструкция выполнялась путем подшивания передней поверхности детрузора к остаткам дорсального венозного комплекса, к лоннопростатическим связкам, к эндопельвикальной фасции в случае ее сохранения. Благодаря преимуществам роботической системы da Vinci Si и использованию шовного материала с насечками период освоения данных методик был весьма коротким. Данная техника была применена почти у половины пациентов 2-й группы и у всех пациентов 3-й группы (n = 101). Восстановлением удержания мочи считалось использование максимум 1 прокладки в сутки. Таким образом, через 3 мес после операции общая частота восстановления удержания мочи составила 51,6 %, а через 6 мес – 63,7 %. При сравнении восстановления удержания мочи между 2 группами пациентов (первым 145 пациентам не выполнялась передняя и задняя реконструкция, остальным 100 пациентам выполнена и передняя, и задняя реконструкция) частота удержания мочи через 3 мес: 45,3 и 64,1 % соответственно (р = 0,041), а после 6 мес мочу удерживали 62,3 и 74,7 % пациентов соответственно (р = 0,034). Восстановлением эректильной функции считалась возможность совершить половой акт без использования ИФДЭ-5 или с его использованием. Через 6 мес у пациентов, которым выполнена нервосберегающая РАРП, этот показатель достиг 50,9 %. Статистически значимых различий между группами не выявлено. Результаты патоморфологического исследования представлены в табл. 4. Группа по ISUP и патоморфологические стадии рТ и pN при изучении гистологического материала не отличались между группами (р = 0,2). Экстрапростатическое прорастание наблюдалось в 6,2 % случаев, в семенные пузырьки – в 9,3 %. Общее значение ПХК обнаружено в 12,82 %. Значение ПХК значимо не из- менялось от группы к группе (p >0,05).
Таблица 4. Результаты патоморфологического исследования Table 4. Results of pathomorphological examination
| Показатель/Parameter | Всего Total (n = 246) |
1-я группа 1st group |
2-я группа 2nd group |
3-я группа 3rd group |
р |
|---|---|---|---|---|---|
| Патоморфология (рТ), n (%) Pathomorphology (pT), n (%) pT2 pT3a pT3b |
206 (83,8) 17 (6,9) 23 (9,3) |
69 (84,2) 7 (8,5) 6 (7,3) |
69 (84,1) 4 (4,9) 9 (11,0) |
68 (82,9) 6 (7,3) 8 (9,8) |
0,53 |
| Патоморфология (рN), n (%) Pathomorphology (pN), n (%) pNo pN1 |
243 (95,1) 12 (4,9) |
79 (96,3) 3 (3,7) |
78 (95,1) 4 (4,9) |
77 (78,0) 5 (6,1) |
0,53 |
| ISUP после операции, n (%) Postoperative ISUP, n (%) 1 2 3 4 5 |
112 (45,5) 90 (36,6) 24 (9,8) 9 (3,9) 10 (10,4) |
43 (52,4) 28 (34,1) 6 (7,3) 1 (1,2)* 4 (4,9) |
33 (40,2) 32 (39,0) 9 (11,0) 4 (4,9) 4 (4,9) |
36 (43,9) 30 (36,6) 9 (11,0) 5 (6,1)* 2 (2,4) |
0,2 |
*Cтатистически значимые различия/ *Statistically significant differences. Примечание. p – уровень значимости различий/ Note. p – significance level.
Обсуждение
За последнее время РАРП стала самым частым хирургическим пособием в лечении локализованного РПЖ. Хирурги предпочитают именно РАРП другим хирургическим методам РПЭ из-за малоинвазивности и короткой кривой обучения [2]. Основными преимуществами роботической системы «Да Винчи» являются: тщательная диссекция тканей благодаря трехмерному бинокулярному виденью с 10-кратным увеличением и манипуляторам с 7 степенями свободы движений, программы подавления тремора при движении инструментами. Обучение начинающих консольных хирургов на роботической системе «Да Винчи» становится значительно проще и быстрее при наличии 2-й консоли хирурга. V.R. Patel и соавт. в своем исследовании обнаружили, что требуется выполнить лишь 25 операций, чтобы завершить обучение РАРП [12]. Впрочем, у каждого хирурга своя кривая обучения, и каждому требуется разное количество случаев для достижения оптимальных результатов. Основной интраоперационный показатель, который меняется с освоением хирургом техники РАРП – это длительность операции. Длительные операции могут быть сопряжены с техническими трудностями и отражать недостаточное совершенствование навыков хирурга [13]. В нашем исследовании медиана длительности операции (skin to skin) составила 160 мин, значительно сократившись от исходного уровня после 88 случаев. N. Doumerc и соавт. сообщают, что требуется 110 случаев для хирурга с предыдущим опытом открытых простатэктомий, чтобы время РАРП составило 180 мин [14]. Полученный результат подтверждается и исследованиями, проведенными E. Haglind и соавт., в которых медиана времени операции в группе РАРП составила 236 (210–270) мин. Медиана объема кровопотери составила 100 мл, значительно снижалась на протяжении всей кривой обучения, достигнув медианы 100 мл во 2-й группе по- сле 100 случаев. По данным мировой литературы, показатели кровопотери при выполнении РАРП варьируют в диапазоне 142–230 мл, являясь еще одним преимуществом перед открытой РПЭ [15]. В нашем исследовании средняя продолжительность катетеризации мочевого пузыря составила 7,15 ± 3,36 дня. Со- гласно B. Rocco и соавт., длительность катетеризации мочевого пузыря составляла в среднем 5 дней [16]. Конечно, главными целями хирургического лечения являются достижение оптимального онкологического результата, в связи с чем ПХК рассматривается как наиболее важный показатель. По данным систематического обзора, проведенного O. Yossepowitch и соавт., общие значения ПХК у разных исследователей колеблются от 6,5 до 32 % [17]. В нашем исследовании общее значение ПХК составило 12,82 %, что сравнимо с данными, приведенными выше. Статистически значимо ПХК не менялся по мере кривой обучения, что говорит в пользу продолжения обучения хирурга после 150 операции. Некоторые исследователи связывают это с тем, что «пере- ломная точка» (tipping point) еще бывает не пройдена [18]. Интересными представляются и данные V.R. Patel и соавт., которые показали, что ПХК может значительно меняться после 1500 случаев: 12,2 % – от 1 до 300 слу- чаев, 6,6 % – для 301–600 операций, 13,6 % – для 601– 900 случаев, 11 % – для 901–1200 случаев и 1,8 % – для 1201–1500 случаев [19]. G. Ploussard и соавт. установили, что общий пока- затель удержания мочи (1009 случаев), оцениваемый как отсутствие необходимости в прокладках, после РАРПчерез3мессоставил50%,ачерез6мес–72% [20]. Это было сравнимо с нашими результатами удержания мочи в группе без реконструкции опорно-связочного аппарата малого таза: через 3 мес – 45,3 %, а через 6 мес – 62,3 %. Следует отметить, что в группе пациентов, где проводилась реконструкция опорно- связочного аппарата малого таза, показатели раннего 1 ТОМ 22 / VOL. 22 2021 восстановления удержания мочи были гораздо лучше: через3мес–64,1 %,ачерез6мес–74,7 %(р=0,034). Другой важный показатель качества жизни – состояние эректильной функции. В нашем исследовании оно оценивалось по шкале МИЭФ-5 и по способности пациента вести половую жизнь. Общий показатель восстановления эректильной функции через 6 мес после операции составил 50,9 %. Согласно G. Ploussard и соавт., восстановление достаточной для проведения полового контакта функции возникло у 42 % пациентов [20].
Заключение
Таким образом, следует отметить, что робот-ассистированная радикальная простатвезикулэктомия имеет короткую кривую обучения, низкий уровень кровопотери, способствует сокращению периода нахождения пациента в стационаре. Для более раннего восстановления удержания мочи необходимо выполнять реконструкцию опорно-связочного аппарата малого таза.









