Осложнения робот-ассистированных и лапароскопических резекций почек
Цель исследования – анализ осложнений при лапароскопической и робот-ассистированной резекции почек. Материалы и методы. Изучены интра- и послеоперационные осложнения у 246 больных раком почки, которым была выполнена резекция почки. Лапароскопический метод использовали в 68 (27,3 %), робот-ассистированный – в 178 (71,5 %) случаях. Интраоперационные осложнения оценивали по классификации Rosenthal, послеоперационные осложнения – согласно классификации Clavien–Dindo.
Результаты. Общая частота интраоперационных осложнений составила 12,6 %. Самым частым интраоперационным осложнением было кровотечение, не требующее гемотрансфузии (grade I), – 5,69 % (при лапароскопическом доступе – в 3 (4,41 %), при робот-ассистированном – в 11 (6,18 %) случаях). Кровотечения, потребовавшие гемотрансфузии, и повреждения внутренних органов, которые были восстановлены интраоперационно (grade II), зафиксированы при лапароскопическом и робот-ассистированном доступах в 4,41 и 2,25 % случаев соответственно. Осложнения, приведшие к утрате какого-либо органа (нефрэктомия, спленэктомия), наблюдались в 2,94 и 4,49 % случаев соответственно. Интраоперационных летальных исходов (grade IV) не зарегистрировано. Частота послеоперационных осложнений составила 18,29 %. Малые осложнения (≤II степени тяжести по классификации Clavien–Dindo) выявлены у 16 (6,5 %) пациентов (при лапароскопическом доступе – у 7,35 %, при робот-асси- стированном – у 6,18 %). Серьезные осложнения (≥III степени тяжести по классификации Clavien–Dindo) выявлены в 29 (11,79 %) случаях (при лапароскопическом доступе – в 14,71 %, при робот-ассистированном – в 10,67 %). При опухолях с индексом RENAL 4–6 частота послеоперационных осложнений составила при лапароскопическом доступе 14,7 %, при робот-ассистированном – 7,1 %; с RENAL 7–9 – 21,9 и 13,0 % соответственно. В группе опухолей высокой сложности (RENAL 10–12) применялся только робот-ассистированный доступ, частота послеоперационных осложнений составила 22,0 %.
Заключение. Резекция почки при опухолях почек – эффективное и безопасное хирургическое пособие. Частота осложнений при использовании лапароскопического доступа выше, чем при применении робот-ассистированной методики в группах опухолей низкой и средней сложности. При опухолях высокой сложности робот-ассистированный доступ является приоритетным. Наибольшее количество серьезных осложнений наблюдается при резекции почек со сложными опухолями.
Введение
Основным методом лечения больных, страдающих раком почки, наряду с радикальной нефрэктомией яв- ляется резекция почки [1, 2]. В современных руководствах рекомендовано выполнять резекцию опухолей почек во всех случаях, когда это возможно [3, 4]. В последние десятилетия произошло смещение приоритета в сторону использования малоинвазивных методик (лапароскопических и робот-ассистированных) в хирургии рака почки, в том числе при выполнении органосохраняющих операций [5, 6]. Эти виды хирургического лечения демонстрируют отличные интра- и послеоперационные результаты (малый объем кровопотери, короткий период госпитализации и реабилитации), хотя считаются более сложными и требуют специализированных навыков хирурга [1, 2]. Робот-ассистированные операции нашли свое распространение в онкоурологии и позволили значительно расширить показания для резекции почки [7]. Малоинвазивная резекция почки ввиду своей сложности сопровождается большей частотой осложнений по сравнению с малоинвазивной радикальной нефрэктомией [8, 9]. Частота осложнений и их характер при выполнении органосохраняющих вмешательств широко освещены в зарубежной литературе, тогда как в отечественной литературе описаны крайне скудно.
Цель исследования – освещение специфических осложнений при лапароскопической и робот-ассистированной резекции почки и оценка результатов малоинвазивного органосохраняющего лечения 248 больных, страдающих раком почки.
Специфические осложнения при резекции почки, профилактика и методы борьбы с ними
Кровотечение. Одним из наиболее частых осложнений резекции почки является кровотечение, которое может возникать в ходе и после оперативного вмешательства как в раннем, так и в отдаленном периоде. Это связано с высокой степенью кровоснабжения и особой системой архитектоники сосудов паренхиматозного органа. Для минимизации кровопотери операции на почке выполняют с определенными приемами, цель которых – снижение/ликвидация кровотока в органе или его части (ишемия тотальная, сегментарная, общая гипотония). При небольших новообразованиях почки возможна их резекция без применения ишемии. В целях минимизации рисков интраоперационного кровотечения обязательно проводится предоперационное планирование (создание трехмерной компьютерной модели), которое включает изучение топографии сосудов, кровоснабжающих почку и опухоль, а также выбор адекватного типа применяемой ишемии почки. Качественная визуализация операционного поля, диссекция почечных сосудов независимо от размера опухоли, клипирование сосудов, непосредственно питающих опухоль, наложение гемостатических швов после резекции образования являются профилактикой данного осложнения во время выполнения хирургического пособия.
Причинами интраоперационного кровотечения при органосохраняющей операции могут быть наличие добавочной почечной артерии, не выявленной при компьютерной томографии (КТ), недостаточное пережатие почечной артерии сосудистым зажимом, венозное кровотечение вследствие ретроградного кровотока. Массивное кровотечение также может возникнуть при восстановлении кровотока в почке или ее сегменте после удаления сосудистых зажимов вследствие неадекватности гемостатических швов, наложенных на паренхиму почки.
В случае возникновения массивного кровотечения при выполнении резекции без какого-либо варианта ишемии или с вариантом сегментарной ишемии оптимальным является наложение сосудистого зажима типа «бульдог» на почечную артерию или зажима Сатинского на почечную ножку и продолжение операции в режиме тотальной ишемии. При повреждении почечных сосудов при их диссекции проводится ушивание дефекта (пролен 4/0–5/0). Ушивание дефекта артериального сосуда следует осуществлять при его пережатии проксимальнее повреждения. При повреждении нижней полой или почечной вены интенсивность венозного кровотечения возможно уменьшить путем повышения давления газа в брюшной полости (под контролем уровня гиперкапнии), что улучшит условия наложения сосудистого шва.
Кровотечение из паренхимы почки после снятия зажимов с почечной ножки говорит о неадекватном ушивании сосудов паренхимы. В этой ситуации также стоит повысить инсуфляционное давление в брюшной полости, проводить компрессию инструментами на почечную ткань в зоне резекции с одновременным наложением дополнительных швов на дефект паренхимы с подтягиванием предыдущих. Повторное наложение сосудистых зажимов на почечную ножку не проводится. При развитии неконтролируемого кровотечения и неэффективности попыток его остановки стоит перейти к выполнению экстренной радикальной нефрэктомии. При невозможности ее выполнения лапароскопическим доступом следует перейти к традиционныму открытыму вмешательству.
Причиной ранних послеоперационных кровотечений (1-е сутки) является недостаточная обработка сосудов паренхимы почки при ее реконструкции. Способствовать кровотечению могут значительные колебания артериального давления у пациента и/или применение избыточной антикоагулянтной терапии. Признаки послеоперационного кровотечения – нестабильность гемодинамики, снижение уровня гемоглобина, значительное отделение крови по страховому дренажу. Данные, полученные при экстренной КТ и/или ультразвуковом исследовании, позволяют выбрать консервативный или оперативный подход в лечении этого осложнения. Развитие отсроченного (через несколько недель/ месяцев после операции) кровотечения в большинстве случаев проявляется стойкой гематурией и может свидетельствовать о формировании псевдоаневризмы или артериовенозной фистулы. В этом случае пациент нуждается в выполнении КТ-ангиографии с последующей ангиоэмболизацией источника кровотечения. Если ангиоэмболизация неэффективна, в качестве крайней меры возможно прибегнуть к хирургическому лечению, вплоть до выполнения нефрэктомии.
Мочевые затеки. В момент выполнения органосохраняющей операции при крупных, сложных и интрапаренхиматозных опухолях возможно преднамеренное или непреднамеренное повреждение целостности чашечно-лоханочной системы (ЧЛС) почки. Своевременная интраоперационная визуализация такого дефекта дает возможность его ушивания и исключает попадание мочи за пределы почки. Однако, если резекция новообразования проводится в условиях геморрагии, то отсутствует возможность выявления и закрытия дефекта ЧЛС интраоперационно, что приводит в дальнейшем к мочевым затекам.
Большое количество отделяемого по страховому дренажу в раннем послеоперационном периоде (более 200 мл/сут) может указывать на повреждение ЧЛС почки. В такой клинической ситуации биохимическое исследование отделяемого по дренажу в целях оценки уровня креатинина позволит диагностировать это осложнение. КТ-урография также поможет определить наличие и локализацию дефекта ЧЛС. При идентифицировании уриномы/урогематомы необходимы ее удаление методом чрескожного дренирования под ультразвуковым наведением и ретроградная установка внутреннего мочеточникового стента для восстановления естественного пассажа мочи. Этот маневр приводит к герметизации ЧЛС. Повторные операции в целях хирургического закрытия дефекта ЧЛС рассматриваются в исключительных случаях.
Неспецифические осложнения резекции почки
Повреждение внутренних органов чаще всего происходит в момент установки портов или при заведении эндохирургических инструментов в брюшную полость. Повреждение паренхиматозных органов (печень и селезенка) довольно быстро проявляет себя кровотечением, и в силу этого повреждение выявляется интраоперационно. Для устранения небольших источников повреждения возможно использование монополярной и/или аргонно-плазменной коагуляции. Однако при сохранении жизнеугрожающего кровотечения, неадекватности малоинвазивного гемостаза необходимо привлечение специалистов общехирургического профиля для консультирования и выполнения хирургических пособий (ушивание раны, тампонирование, резекция или удаление органа).
Повреждение кишечника также является серьезным осложнением резекции почки, особенно если его не распознать в момент операции. Оказание пособия при повреждении полых органов зависит от локализации и величины дефекта. В случае небольшого повреждения кишки возможно интраоперационное его ушивание. При массивных дефектах или в случае отсутствия у хирурга соответствующего опыта показа- на конверсия с привлечением специалистов. При не выявленном интраоперационно повреждении полого органа в послеоперационном периоде характерны боли и вздутие живота, тошнота, лихорадка, лейкоцитоз в крови, а также появление кишечного отделяемого по страховым дренажам. В таких ситуациях необходимы экстренная хирургическая ревизия органов брюшной полости и устранение дефекта кишечника ввиду возможного прогрессирования перитонита и развития септического состояния с угрозой летального исхода.
Инфекционно-воспалительные осложнения. При массивном повреждении паренхимы почки и/или повреждении целостности ЧЛС почки в послеоперационном периоде возможно развитие острого пиелонефрита. Характерными симптомами данного осложнения являются фебрильная лихорадка, боли в поясничной области, нарастание лейкоцитоза в крови. Для исключения обструктивного характера острого пиелонефрита необходимо выполнить ультразвуковое исследование почек. При подозрении на наличие очаговых образований в паренхиме/паранефральной клетчатке почки показано выполнение КТ с контрастированием. Посев мочи на флору и чувствительность к антибактериальным препаратам позволит определить ее микробиологический состав и подобрать антибактериальный препарат.
Материалы и методы
В урологическом отделении Городской больницы No40 г. Санкт-Петербурга в период с августа 2012 г. по сентябрь 2020 г. под наблюдением находились 248 пациентов, которым было выполнено органосохраняющее хирургическое лечение по поводу рака почки. Было выполнено 249 вмешательств (1 пациентке с двусторонним поражением почек последовательно проведены вмешательства с обеих сторон). Всем па- циентам планировалась и выполнена резекция почки, но у 9 (3,66 %) больных вследствие различных причин операция завершилась нефрэктомией. Робот-ассистированный метод использовался в 178 (71,5 %), лапароскопический – в 68 (27,3 %) и открытый – в 3 (1,2 %) случаях. Проспективно оценивали послеоперационные осложнения в течение 12 мес.
В настоящее исследование были включены 246 из 249 вмешательств с использованием малоинвазивных методов (лапароскопического и робот-ассистированного). Всем пациентам перед операцией было проведено обследование, включавшее стандартные лабораторные, клинические и инструментальные исследования, в том числе КТ или магнитно-резонансную томографию органов брюшной и грудной полости. Демографические и клинические данные пациентов представлены в табл. 1.
Таблица 1. Демографические и клинические характеристики пациентов/ Table 1. Demographic and clinical characteristic of patients
| Характеристика/Characteristic | Всего/Total | Лапароcкопическая операция/Laparoscopic surgery | Робот-ассистированная операция/Robot-assisted surgery | p |
|---|---|---|---|---|
| Число вмешательств, n (%)/ Number of operation, n (%) | 249 (100)* | 68 (27,31) | 178 (71,49) | – |
| Возраст пациентов, медиана (IQR), лет/Median age (IQR), years | 61,48 (53,02–67,49) | 64,0 (57,6–69,0) | 60,0 (50,8–66,4) | 0,0004 |
| Пол, n (%)/Gender, n (%): мужской/male женский/female |
135 (54,22) 114 (45,78) |
33 (48,53) 35 (51,47) |
100 (56,18) 78 (43,82) |
– |
| Индекс массы тела, медиана (IQR), кг/м2/ Median body mass index (IQR), kg/m2 |
28,26 (24,8–31,14) | 27,97 (24,28– 31,14) | 28,02 (24,82– 31,27) | 0,5 |
| Размер новообразования, медиана (IQR), cм/ Median tumor size (IQR), cm |
3,85 (2,8–4,9) | 3,0 (2,2–4,0) | 4,15 (3,1–5,2) | 0,00001 |
| Клиническая стадия заболевания, n (%)/ Clinical stage, n (%): cT1a cT1b cT2a |
141 (56,63) 92 (37,35) 15 (6,02) |
54 (79,41) 13 (19,12) 1 (1,47) |
85 (47,75) 79 (44,38) 14 (7,87) |
– |
| Индекс по шкале RENAL, медиана (IQR)/ Median RENAL index (IQR) | 8 (6–9) | 6,5 (5–8) | 8 (7–10) | 0,00001 |
| Индекс по шкале RENAL, n (%)/ RENAL index, n (%): 4–6 7–9 10–12 |
62 (24,9) 135 (54,22) 52 (20,88) |
34 (50,0) 32 (47,06) 2 (2,94) |
28 (15,73) 100 (56,18) 50 (28,09) |
– |
*В исследование не включены 3 больных, которым выполнены 3 открытые операции. Примечание. Здесь и в табл. 2: IQR – межквартильный размах./*The study did not include 3 patients who underwent 3 open operations. Note. Here and in table 2: IQR – interquartile range.
В группе пациентов, подвергшихся лапароскопической резекции почки, преобладали женщины, возраст пациентов на момент операции составил 64,0 (57,6– 69,0) года. Медиана размера образования почки соста- вила 3,0 (2,2–4,0) см. По клинической стадии заболевания пациенты были распределены следующим образом: сТ1а – 54 (79,41 %), сТ1b – 13 (19,12 %), сТ2а – 1 (1,47 %); по нефрометрическому индексу RENAL: 4–6 баллов – 34 (50,0 %), 7–9 баллов – 32 (47,06 %), 10–12 баллов – 2 (2,94 %). Пациенты группы робот-ассистированной резекции почки имели достоверно меньший возраст – 60 (50,8– 66,4) лет, больший размер новообразования почки – 4,15 (3,1–5,2) см и более сложные (по шкале RENAL) опухоли (p <0,005). Стадии сТ1а, сТ1b и сТ2а определялись в 85 (47,75 %), 79 (44,38 %), 14 (7,87 %) случаях соответственно. Опухоли с нефрометрическим индексом RENAL 4–6 определялись в 28 (15,73 %) случаях, RENAL 7–9 – в 100 (56,18 %), RENAL 10–12 – в 50 (28,09 %). Следует подчеркнуть, что пациентам с крупными (>4,0 см) и сложными (по шкале RENAL) опухолями преимущественно выполняли робот-ассистированные вмешательства, тогда как при малых опухолях – лапароскопические. Интраоперационные и клинические данные пациентов представлены в табл. 2.
Таблица 2. Операционные и клинические данные пациентов/Table 2. Surgical outcomes
| Характеристика/Characteristic | Всего/Total | Лапароcкопическая операция/Laparoscopic surgery | Робот-ассистированная операция/Robot-assisted surgery | p |
|---|---|---|---|---|
| Число пациентов, n (%)/ Number of patients, n (%) | 246 (100) | 68 (27,31) | 178 (71,49) | – |
| Операционный доступ, n (%)/ Surgical approaches, n (%): трансабдоминальный/transabdominal забрюшинный/retroperitoneal |
213 (86,59) 33 (13,41) |
53 (77,94) 15 (22,06) |
160 (89,89) 18 (10,11) |
– |
| Длительность операции, медиана (IQR), мин/ Median duration of surgery (IQR), min |
160 (130–190) | 145 (115–170) | 165 (140–205) | 0,0005 |
| Объем кровопотери, медиана (IQR), мл/Median blood loss (IQR), ml | 100 (50–275) | 100 (50–300) | 100 (50–200) | 0,84 |
| Гемотрансфузия, n (%)/Blood transfusion, n (%) | 14 (5,69) | 5 (7,35) | 7 (3,93) | 0,29 |
| Тип ишемии, n (%)/Type of ischemia, n (%): без ишемии/zero ischemia сегментарная ишемия/segmental ischemia тотальная тепловая ишемия/total warm ischemia |
33 (13,41) 47 (19,11) 166 (67,48) |
18 (26,47) 5 (7,35) 45 (66,18) |
15 (8,43) 42 (23,6) 121 (67,98) |
– |
| Длительность госпитализции, медиана (IQR), сут/Median duration of hospital stay (IQR), days | 5 (4–7) | 6 (4–8) | 5 (4–7) | 0,14 |
В обеих группах в подавляющем большинстве слу- чаев (86,75 %) использовали трансабдоминальный доступ. Медиана длительности операции составила 160 (130–190) мин. Зафиксировано достоверное увеличение продолжительности операции в группе робот- ассистированной резекции почки по сравнению с лапароскопической резекцией. Объем кровопотери и частота гемотрансфузии достоверно не различались. При выборе типа ишемии почки отмечается выраженное преобладание использования тотальной тепловой ишемии (67,48 %). Сегментарная ишемия применялась в 19,11 % случаев, без ишемии резекция почки выполнена в 13,41 % случаев. Продолжительность госпитализации достоверно не различалась. Операции выполнялись одним хирургом с применением лапароскопической и робот-ассистированной методики (роботизированная хирургическая система da Vinci Si (Intuitive Surgical, США)). Любое отклонение от нормального течения хирургического пособия и / или послеоперационного периода расценивали как осложнение. Интраоперационные осложнения оценивали по классификации Rosenthal [10]. В табл. 3 приведена классификация интраоперационных осложнений и их ранжирование по grade. Стратификацию послеоперационных осложнений проводили согласно классификации послеоперационных осложнений Clavien–Dindo [11]. Все удаленные органы и ткани подвергали гистологическому исследованию в целях морфологической верификации диагноза и стадирования онкологического процесса. Статистический анализ результатов выполняли с помощью стандартных программ (MS Office, Statistica 9.0).
Таблица 3. Классификация интраоперационных осложнений (Rosenthal R., 2015)/Table 3. Classification of intraoperative complications (Rosenthal R., 2015)
| Grade | Определение/Definition |
|---|---|
| 0 | Нет отклонений от нормального хода оперативного вмешательства/ No deviation from the ideal intraoperative course |
| I | Любое отклонение от идеального плана оперативного вмешательства без необходимости какого-либо дополнительного лечения или вмешательства/Any deviation from the ideal intraoperative course without the need for any additional treatment or intervention |
| II | Любое отклонение от идеального плана оперативного вмешательства с необходимостью какого-либо дополнительного лечения или вмешательства без угрозы жизни и не приводящего к постоянной нетрудоспособности/Any deviation from the ideal intraoperative course with the need for any additional treatment or intervention not life-threatening and not leading to permanent disability |
| III | Любое отклонение от идеального плана оперативного вмешательства с необходимостью какого-либо дополнительного лечения или вмешательства с угрозой жизни и/или приводящего к постоянной нетрудоспособности/Any deviation from the ideal intraoperative course with the need for any additional treatment or intervention life-threatening and/or leading to permanent disability |
| IV | Любое отклонение от идеального плана оперативного вмешательства, приведшее к летальному исходу/Any deviation from the ideal intraoperative course with death of the patient |
Для сопоставления результатов исследований зависимых групп использовали критерий Уилкоксона, независимых – критерий Фишера. Статистически значимым для всех показателей считали критерий достоверности p <0,05.
Результаты
Интраоперационные осложнения и их стратификация по классификации Rosenthal приведены в табл. 4. Интраоперационные осложнения выявлены у 30 (12,2 %) пациентов. К grade I были отнесены кровотечения объемом более 500 мл, не потребовавшие гемотрансфузии. Это осложнение чаще фиксировали при робот-ассистированных операциях (11 (6,18 %) случаев), чем при лапароскопических (3 (4,41 %) случая). Grade II фиксировали при интраоперационном кровотечении с необходимостью гемотрансфузии, а также при повреждении каких-либо органов, которые были восстановлены интраоперационно (в 1 случае при лапароскопической операции была повреждена диафрагма, проведено ее ушивание без дренирования плевральной полости). Эти осложнения чаще встречались при лапароскопическом доступе. К grade III (осложнения, приведшее к потере органа) отнесены все случаи нефрэктомии (у 2 (2,94 %) оперированных лапароскопическим доступом и у 7 (3,93) – робот-ассистированным доступом). Причинами перехода к нефрэктомии являлись повреждение почечной артерии клипатором (n = 1), массивное кровотечение вследствие недиагностированной дополнительной почечной артерии (n = 1), а также при неадекватных гемостатических швах, наложенных на паренхиму почки (n = 5). У 2 пациентов решение об удалении органа было принято вследствие интраоперационных находок (выраженный склероз паранефральной клетчатки), которые не позволили осуществить первоначальный план операции. Также в 1 случае в хо- де вмешательства повреждена селезенка, что привело к удалению органа.
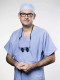
В течение года наблюдения зафиксировано 45 послеоперационных осложнений у 38 (15,45 %) пациентов. В табл. 5 приведены послеоперационные осложнения согласно классификации Clavien–Dindo. Малые осложнения (≤II степени тяжести по Clavien–Dindo, которые не требовали или разрешились после медика- ментозного лечения) диагностированы у 16 (6,5 %) пациентов. Частота малых осложнений при лапароскопических вмешательствах составила 7,35 %, при робот-ассистированных – 6,18 % (р ≥0,05). Серьезные осложнения (≥III степени тяжести по классификации Clavien–Dindo) выявлены в 29 (11,79 %) случаях: при лапароскопическом доступе – в 14,71 %, при робот-ассистированном – в 10,67 %. В группе grade III осложнения преимущественно пред- ставлены послеоперационными кровотечениями, которые в 2 случаях были разрешены путем пункции, в 7 случаях – ревизией и удалением гематомы, только в 1 случае потребовалась нефрэктомия. Дефект ЧЛС с затеканием мочи в паранефральную клетчатку диагностирован у 8 оперированных, у 7 из них выполнено стенти- рование мочеточника и у 1 – повторное оперативное вмешательство в целях резекции открытой чашечки почки. Жизнеугрожающее осложнение (grade IV) выявлено в 1 случае (инфаркт миокарда) и в 1 случае зафиксирован летальный исход (grade V) вследствие кровотечения неизвестной этиологии через 2 мес после операции. На рис. 1 представлена общая частота интраоперационных и послеоперационных осложнений при резекции новообразований почки различной степени сложности. В нашем анализе количество интраоперационных осложнений преобладало в группе опухолей средней сложности (15,2 %), в группе опухолей низкой сложности этот показатель достиг 8,1 %, в группе опухолей высокой сложности – 9,6 %. Частота развития послеоперационных осложнений в группах опухолей высокой и средней сложности сопоставима, однако в группе опухолей высокой сложности отмечается преобладание серьезных осложнений (≥III степени тяжести по классификации Clavien–Dindo).
Таблица 4. Интраоперационные осложнения (Rosenthal R., 2015)/Table 4. Intraoperative complications (Rosenthal R., 2015)
| Grade | Всего, n (%)/Total, n (%) | Лапароcкопическая операция (n = 68), n (%)/ Laparoscopic surgery (n = 68), n (%) | Робот-ассистированная операция (n = 178), n (%)/ Robot-assisted surgery (n = 178), n (%) | p |
|---|---|---|---|---|
| I | 14 (5,69) | 3 (4,41) | 11 (6,18) | 0,58 |
| II | 7 (2,85) | 3 (4,41) | 4 (2,25) | 0,39 |
| III | 10 (4,07) | 2 (2,94) | 8 (4,49) | 0,7 |
| IV | – | – | – | – |
| Всего/Total | 31 (12,6) | 8 (11,76) | 23 (12,92) |
Таблица 5. Послеоперационные осложнения/Table 5. Postoperative complications
| Grade | Всего, n (%)/Total, n (%) | Лапароcкопическая операция (n = 68), n (%)/ Laparoscopic surgery (n = 68), n (%) | Робот-ассистированная операция (n = 178), n (%)/ Robot-assisted surgery (n = 178), n (%) | p |
|---|---|---|---|---|
| I | 5 (2,03) | 2 (2,94) Гипертермия – 2 Hypertermia – 2 |
3 (1,69) Кровотечение – 1 Гипертермия – 2 Bleeding – 1 Hypertermia – 2 |
– |
| II | 11 (4,47) | 3 (4,41) Кровотечение – 2 Острая задержка мочи – 1 Bleeding – 2 Acute urinary retention – 1 |
8 (4,49) Кровотечение – 1 Макрогематурия – 1 Воспалительные – 6 Bleeding – 1 Hematuria – 1 Inflamation – 6 |
0,98 |
| IIIа | 11 (4,47) | 3 (4,41) Мочевой свищ – стентирование – 2 Эмболизация артериовенозной фистулы – 1 Urine leak – ureter stent – 2 Embolization of arteriovenosal fistula – 1 |
8 (4,49) Мочевой свищ – стентирование – 5 Пункция гематомы – 2 Эмболизация артериовенозной фистулы – 1 Urine leak – ureter stent – 5 Puncture of hematoma – 2 Embolization of arteriovenosal fistula – 1 |
0,98 |
| IIIb | 16 (6,5) |
7 (10,29) Кровотечение – ревизия – 5 Герниопластика – 2 Bleeding – surgical revision – 5 Herniaplasty – 2 |
9 (5,06) Кровотечение – ревизия – 5 Кровотечение – нефрэктомия – 2 Мочевой свищ – резекция – 2 Bleeding – surgical revision – 2 Bleeding – nephrectomy – 2 Urine leak – resection – 2 |
0,16 |
| IV | 1 (0,41) | – | 1 (0,56) Инфаркт миокарда – 1 Myocardial infarction – 1 |
– |
| V | 1 (0,41) | – | 1 (0,56) Кровотечение неизвестной этиологии – 1 Bleeding of unknown etiology – 1 |
– |
На рис. 2 отображена частота развития послеоперационных осложнений при использовании лапароскопического и робот-ассистированного хирургического доступа в зависимости от сложности опухоли. В группе опухолей с нефрометрическими индексами RENAL 4–6 и RENAL 7–9 частота развития послеоперационных осложнений была значимо выше при использовании лапароскопического доступа (p ≤0,05). Стоит отметить тот факт, что органосохраняющие операции в группе опухолей высокой сложности, за редким исключением, выполнялись робот-ассистированным доступом. На рис. 3 отображена динамика развития интра- и послеоперационных осложнений (≥III степени тяжести по классификации Clavien–Dindo) в сопоставлении с частотой выполненных органосохраняющих операций при опухолях высокой сложности (RENAL 10–12). Наибольшая частота развития осложнений наблюдалась на этапе набора хирургического опыта (2012–2014 гг.).
Рис. 1. Общая частота интраоперационных и послеоперационных (≤II и ≥III степени тяжести по классификации Clavien–Dindo) осложнений при резекции новообразований почки различной степени сложности/Fig. 1. The overall incidence of intraoperative and postoperative (Clavien–Dindo ≤II and Clavien–Dindo ≥III) complications in partial nephrectomy of varying degrees of complexity
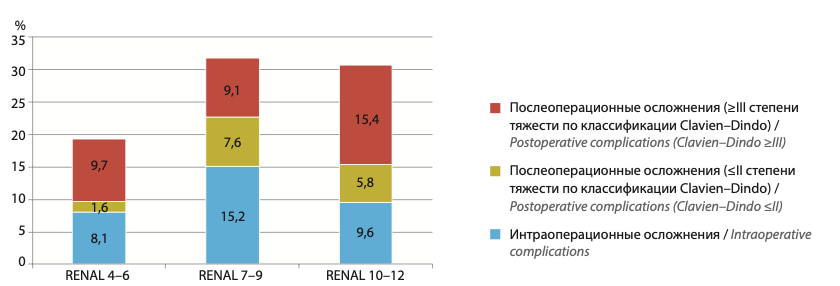
Рис. 2. Частота послеоперационных осложнений после лапароскопической и робот-ассистированной резекции новообразования почки различной степени сложности/ Fig. 2. The incidence of postoperative complications after laparoscopic and robotic-assisted partial nephrectomy of varying degrees of complexity
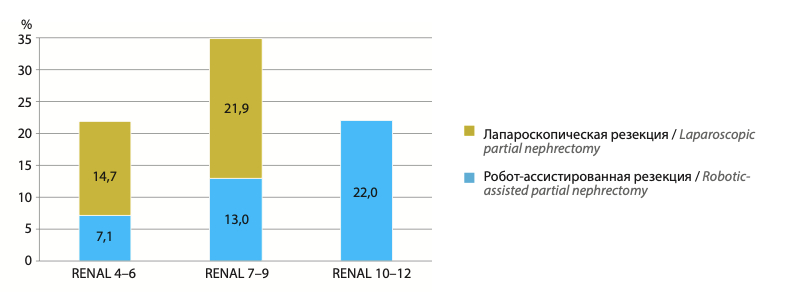
Рис. 3. Динамика частоты интраоперационных и послеоперационных осложнений (≥III степени тяжести по классификации Clavien–Dindo) в сопоставлении с частотой выполненных органосохраняющих операций при опухолях высокой сложности (RENAL 10–12)/ Fig. 3. Dynamics of the incidence of intraoperative and postoperative complications (Clavien–Dindo ≥III) in comparison with the incidence of performed nephron-sparing surgeries for complex tumors (RENAL 10–12)
Обсуждение
В нашей выборке развитие интраоперационных осложнений при резекции почки зафиксировано в 12,2 % случаев. Наиболее частым из них было кровотечение. Частота острых кровотечений, требующих гемотрансфузии, после резекции почки колеблется от 1,2 до 9,9 % [12–14]. В нашем исследовании общая частота интраоперационных кровотечений составила 7,7 % и только в 2,03 % случаев пациенты нуждались в гемотрансфузии. J. Furukawa и соавт. в исследовании, включившем данные 804 пациентов, сообщают о более низкой частоте интраоперационных осложнений (3,6 %), однако в их исследовании осложнением считали только те кровотечения, которые требовали интраоперационной гемотрансфузии. Авторы также обращают внимание на тот факт, что при медиане индекса RENAL 7 частота интраоперационных осложнений составляет лишь 2,5 %, а при медиане индекса RENAL 8 – уже 8,4 % [6]. В нашем исследовании медиана индекса RENAL составила 8, а частота интраоперационных осложнений – 6,5 % (при исключении кровотечений, не требовавших гемотрансфузии). В рандомизированном исследовании EORTC сообщается, что в 11,5 % случаев выполнения резекции почек наблюдается повреждение внутренних органов, самым частым вариантом является повреждение целостности плевральных полостей, а частота повреждения селезенки составляет 0,4 % [9]. При анализе наших результатов общая частота интраоперационных повреждений внутренних органов при выполнении органосохраняющих операций при опухолях почек составила 0,8 % (1 (0,4 %) повреждение диафрагмы и 1 (0,4 %) повреждение селезенки).
G. Cacciamani и соавт. в своем систематическом обзоре сообщают, что благодаря использованию робот-ассистированных технологий снижается частота как интраоперационных, так и послеоперационных осложнений по сравнению с лапароскопическим доступом [8]. В нашей работе при робот-ассистированном доступе интраоперационные осложнения фиксировались чаще (в том числе конверсия на нефрэктомию). Это можно объяснить тем, что вмешательства при крупных и сложных опухолях проводили преимущественно с применением хирургического робота, тогда как лапароскопический подход использовали в единичных случаях (2 против 50). Несмотря на это, количество послеоперационных осложнений (как ≤II, так и ≥III степени тяжести по классификации Clavien– Dindo) при использовании робот-ассистированного доступа было меньшим.
Развитие серьезных послеоперационных осложнений (≥III степени тяжести по классификации Clavien–Dindo) после органосохраняющих операций определяется в 6–19,6 % случаев [15, 16]. В нашей выборке общая частота развития послеоперационных осложнений в группе пациентов, подвергшихся резекции почки, составила 18,3 % (при робот-ассистированном доступе – 16,9 %, при лапароскопическом доступе – 22,1 %), а частота серьезных осложнений (≥III степени тяжести по классификации Clavien–Dindo) – 11,79 % (при робот-ассистированном доступе – 10,67 %, при лапароскопическом доступе – 14,71 %). В современных публикациях сообщается, что частота образования мочевых затеков составляет до 6,5 %, при этом 3,6 % случаев требовали хирургического вмешательства [17, 18]. В нашем исследовании 3,3 % пациентов нуждались в дренировании ЧЛС почки и пункции урином для устранения мочевого затека. По мнению ряда авторов, имеется прямая зависимость частоты развития интра- и послеоперационных осложнений от размера и сложности опухоли [19]. На сегодняшний день робот-ассистированный доступ является приоритетным для опухолей высокой степени сложности, поскольку демонстрирует лучшие результаты (в том числе в уменьшении числа осложнений) по сравнению с лапароскопическим и традиционным открытым доступами [20, 21]. Частота послеоперационных осложнений после робот-ассистированной резекции почки при крупных опухолях (стадии Т1b–Т2) составляет 4–23 % [22, 23]. N.M. Buffi и соавт. сообщают о 29 % послеоперационных осложнений после робот-ассистированной резекции почек при опухолях высокой сложности (PADUA ≥10) [24]. Результаты нашего исследования также подтверждают тот факт, что наибольшее количество осложнений (21 %) определяется в группе опухолей высокой сложности.