Операция при раке пищевода с помощью робота da Vinci: преимущества и особенности
Введение
Рак пищевода остаётся одной из наиболее грозных злокачественных опухолей: в 2022 году в мире зарегистрировано 511 054 новых случаев и 445 391 смерть. По данным GLOBOCAN-2022, рак пищевода занимает 11-е место по заболеваемости и 7-е по смертности среди всех онкологических заболеваний [1, 2].
В Российской Федерации заболевание сохраняет стабильно высокие показатели. Согласно ежегодному обзору МНИОИ им. П. А. Герцена «Злокачественные новообразования в России в 2023 году» (изд. 2024), в стране выявлено около 6 000 новых случаев (ASR ≈ 5,2 на 100 000 мужчин и 1,3 на 100 000 женщин), при умеренно стабильной динамике [11].
В клинической практике всё шире применяются мини-инвазивные методики удаления пищевода — гибридная (HMIE, hybrid minimally invasive esophagectomy) – когда один из этапов операции выполняется торакоскопически или лапароскопически; полностью мини-инвазивная (cMIE, conventional minimally invasive esophagectomy) – когда оба этапа (торакальный и абдоминальный) выполняются торако- лапароскопически; робот-ассистированная (RAMIE, robot-assisted minimally invasive esophagectomy). Их цель — снизить частоту осложнений с сохранением онкологического радикализма и сопоставимыми отдалёнными результатами [3].
Эволюция хирургических доступов
Исторически резекция пищевода или эзофагэктомия выполнялась открытым способом, что сопровождалось обширной хирургической травмой, большой кровопотерей и высокой частотой лёгочных осложнений. С конца XX века внедрение торако- лапароскопических методик позволило достоверно снизить периоперационные риски и частоту осложнений.
Рандомизированное исследование MIRO (JAMA Surg 2021) показало: гибридная эзофагэктомия снижает частоту крупных осложнений (Clavien-Dindo III–IV — 36 % против 64 % в открытой группе, p = 0,02) при сопоставимой 5-летней выживаемости (≈ 59 % vs 54 %, p = 0,38) [3]. Эти результаты стали основой для внедрения минимально инвазивных и робот-ассистированных методов.
Технологические преимущества системы da Vinci
Системы da Vinci Si/Xi обеспечивают важные технические преимущества при работе в узких пространствах средостения:
- 3D-HD-визуализация с увеличением и стабильным изображением высокой четкости с глубиной восприятия;
- инструменты EndoWrist с 7 степенями свободы — прецизионная диссекция и ушивание;
- фильтрация тремора — стабильность манипуляций у важных анатомических структур (сердца, дыхательных путей, магистральных сосудов, возвратных гортанных нервов).
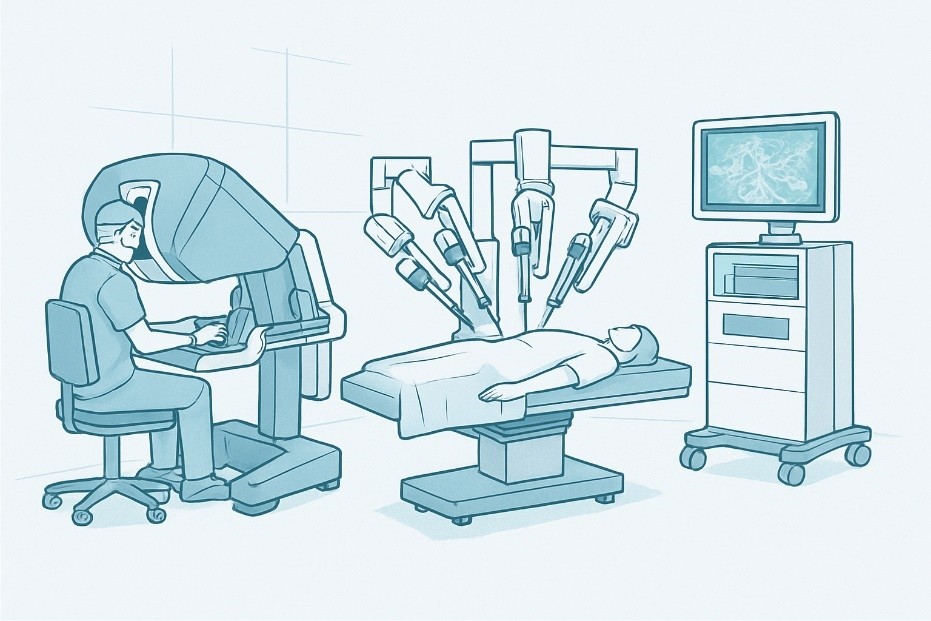 Рис. 1.
Схематическое изображение хирургической системы da Vinci.
Рис. 1.
Схематическое изображение хирургической системы da Vinci.Показания и критерии отбора пациентов
RAMIE выполняют при локализованных и местно-распространённых формах (T1–T3, N0–N1), в том числе после неоадъювантной химио/химолучевой терапии у пациентов с удовлетворительным функциональным статусом. Относительные противопоказания: инвазия T4b, отдалённые метастазы (M1), тяжёлые последствия предшествующих операций, затрудняющие доступ.
Техника и основные подходы
- Айвор Льюис (Ivor Lewis): абдоминальный (лапаро/робот) + торакальный (робот) этап с внутригрудным анастомозом.
- МакКеон (McKeown): трёхэтапная операция (абдоминальный, торакальный, цервикальный) с цервикальным анастомозом.
Роботизированная платформа особенно эффективна на торакальном этапе, обеспечивая устойчивую визуализацию и высокую точность при выделении пищевода с опухолью, лимфодиссекции в заднем средостении. Особые преимущества робот дает при формировании ручного внутриплеврального анастомоза при операции Lewis, и лимфаденэктомии вдоль возвратных гортанных нервов.
Преимущества RAMIE: подтверждения исследований
1. Снижение осложнений без ущерба выживаемости
Рандомизированное исследование MIRO показало уменьшение тяжёлых осложнений на 28 п.п. при аналогичной долгосрочной выживаемости [3].
2. Робот против классической MIE
Мета-анализ (Perry et al., 2024; 18 исследований, > 2 700 пациентов) показал:
- меньшая кровопотеря на ≈ 150 мл (95 % ДИ −230…−80 мл),
- меньший риск пневмонии (ОР 0,71; p < 0,01),
- короче госпитализация на 1,3 дня (95 % ДИ −2,2…−0,5 дня), при длительности операции дольше в среднем на ≈ 40 минут [5].
3. Единственное РКИ RAMIE vs VATS-MIE — REVATE (2024)
Мультицентровое РКИ (Br J Surg 2024) продемонстрировало: лучшее выполнение лимфодиссекции вдоль левого RLN (медиана извлечённых узлов 5 vs 3; p = 0,01), меньше стойких парезов RLN (3 % vs 9 %; p = 0,04), короче время дренирования (3,1 vs 4,5 суток; p = 0,02). Различий в 30-дневной смертности и рецидивах не обнаружено [6].
4. Долгосрочные результаты
ROBOT trial (Ann Surg 2020) и дополнительные когортные данные (ЕJSO 2025) подтвердили сопоставимую 5-летнюю общую и безрецидивную выживаемость между RAMIE и открытой эзофагэктомией (≈ 59 % vs 56 %; p > 0,05) [4, 10].
Онкологическая радикальность и лимфодиссекция
RAMIE обеспечивает более точное стадирование и качественную диссекцию вдоль RLN. В некоторых сериях отмечено увеличение числа удалённых лимфоузлов (медиана 31 vs 27; p = 0,04) и рост частоты R0-резекций; межцентровая вариабельность остаётся высокой.
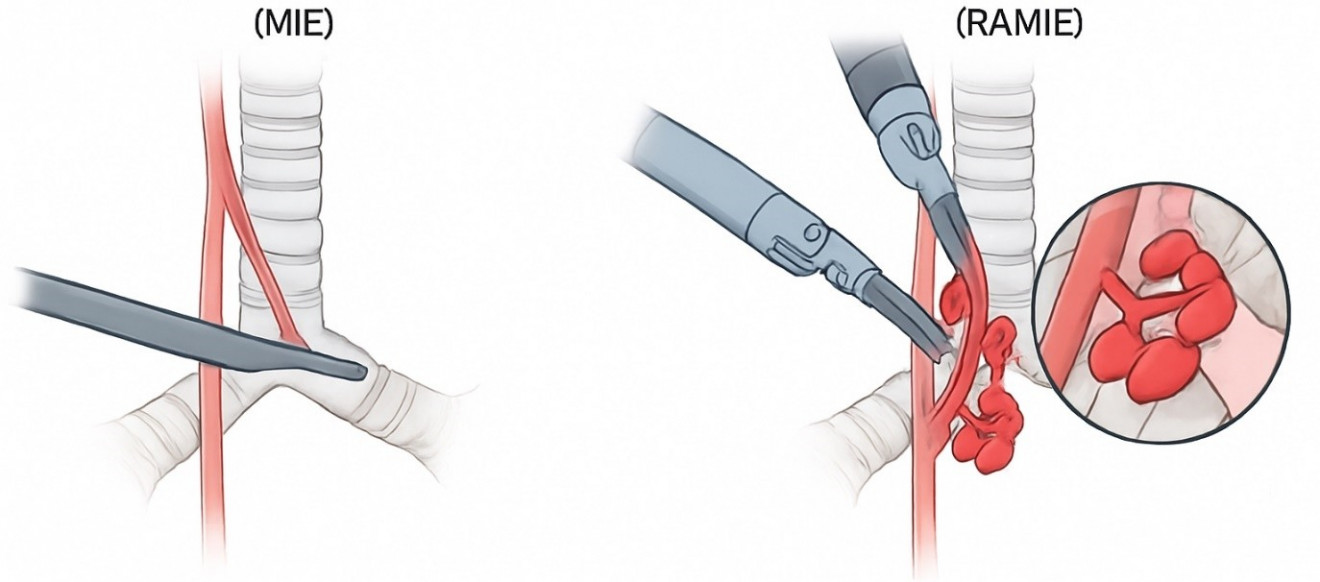 Рис. 2. Сравнение
лимфодиссекции возвратного гортанного нерва (ВГН) при МИЭ и RAMIE.
Рис. 2. Сравнение
лимфодиссекции возвратного гортанного нерва (ВГН) при МИЭ и RAMIE.
ERAS-протоколы при эзофагэктомии
Мета-анализ РКИ (Kennelly et al., 2025; 10 РКИ, ≈ 2 000 пациентов) показал снижение частоты осложнений на 23 %, сокращение госпитализации в среднем на 2,8 дня и ускорение восстановления перистальтики на ≈ 12 часов. Совмещение ERAS и RAMIE даёт наиболее «щадящий» послеоперационный период [7].
Управление перфузией и профилактика несостоятельности анастомоза
Несостоятельность пищеводно-желудочного анастомоза (AL) остаётся одним из наиболее опасных осложнений. Систематический обзор и мета-анализ (Sozzi et al., 2024) показал: использование ICG-ангиографии снижает частоту AL с 12,8 % до 7,6 % (ОР 0,58; p = 0,03) при гетерогенности данных и умеренном уровне доказательности [8].
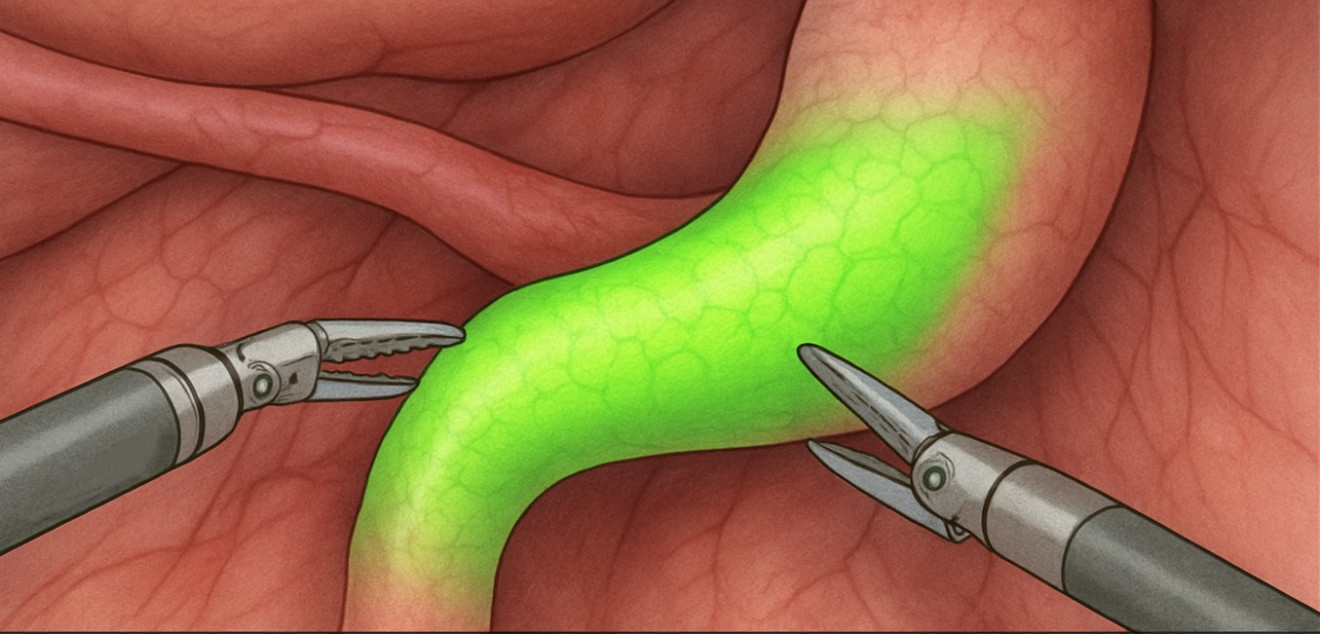 Рис. 3. Применение ICG-флуоресценции для оценки перфузии желудочного трансплантата.
Рис. 3. Применение ICG-флуоресценции для оценки перфузии желудочного трансплантата.
Кривая обучения и стандартизация
По данным van der Sluis et al. (2018), для достижения стабильных результатов необходимо ≈ 40–80 вмешательств; структурированное наставничество и командное обучение позволяют снизить частоту осложнений примерно с 30 % до 15 % по мере накопления опыта. [9].
Для минимизации рисков, связанных с кривой обучения, и обеспечения воспроизводимости результатов ключевое значение имеет стандартизация хирургической техники и строгое следование протоколам. Применение протоколов ERAS (Enhanced Recovery After Surgery), адаптированных для робот-ассистированной эзофагэктомии, способствует оптимизации периоперационного ведения, ранней мобилизации и питательной поддержке, что в совокупности улучшает результаты лечения и сокращает сроки госпитализации.
Экономические аспекты и перспективы
Несмотря на высокие затраты и стоимость расходных материалов, RAMIE может быть экономически оправдана за счёт сокращения госпитализации и уменьшения числа осложнений. По анализу Goense et al., 2023, разница в прямых расходах составляла ≈ +10–15 % по сравнению с открытой эзофагэктомией, но суммарные затраты (с учётом реопераций и реанимации) были эквивалентны между RAMIE и открытой хирургией. Будущее — в развитии платформ с обратной тактильной связью и интеграцией ИИ в навигацию [12].
Заключение
RAMIE на платформе da Vinci — технологически продвинутый метод, с доказанной онкологической безопасностью и клинической эффективностью при лечении рака пищевода. При достаточном опыте команды он обеспечивает сопоставимые онкологические результаты и умеренные преимущества по периоперационным показателям. Успех RAMIE зависит от стандартизации техники, системы обучения и применения инструментов контроля перфузии (ICG) там, где это клинически оправдано.
Рецензирование
Настоящий материал прошёл научно-клиническое рецензирование Ветшевым Фёдором Петровичем — доктором медицинских наук, профессором, специалистом в области минимально инвазивной и робот-ассистированной хирургии с применением системы da Vinci. В ходе рецензирования была оценена корректность терминологии, актуальность клинических данных и соответствие выводов современным представлениям о хирургическом лечении рака пищевода.
Подобрать хирурга

-1x.jpg)
-1x.jpg)
-1x.jpg)