Опыт робот-ассистированной цистэктомии в лечении больных раком мочевого пузыря в условиях одного центра
Аннотация. В работе приведена оценка результатов хирургического лечения мышечно-инвазивного рака мочевого пузыря при помощи роботизированной системы Da Vinci Si. Проанализирован опыт лечения 6 больных, которым в период 2020-2021 г. была выполнена робот-ассистированная цистэктомия. Данные показывают, что эта методика обеспечивает лучшие результаты с точки зрения кровопотери, частоты гемотрансфузий и пребывания в стационаре с эквивалентным онкологическим исходом по сравнению с цистэктомией.
Введение
Злокачественные новообразования (ЗНО) мочевого пузыря в 2019 году составили 2,7% всех ЗНО населения Российской Федерации (РФ), занимая 12 ранговое место в структуре онкологической заболеваемости обоих полов. Прирост заболеваемости за 10 лет составил 30,8%, а среднегодовой темп прироста составил + 2,63%. Стандартизированный показатель заболеваемости в 2019 году вырос на 14,71% [1]. По данным мировой статистики около 20-30% случаев впервые выявленного рака мочевого пузыря (РМП) характеризуется мышечной инвазией (МИРМП), а 20% немышечноинвазивного РМП (НМИРМП) прогрессируют до МИРМП даже с учетом проводимого лечения [2]. При этом за последние 30 лет не достигнуто значительного увеличения выживаемости больных МИРМП [3]. малоинвазивные доступы привлекают большое внимание урологов, занимающихся хирургическим лечением МИРМП [4]. Робот-ассистированная ЦЭ (РАЦЭ) имеет технические преимущества перед лапароскопической (ЛЦЭ): увеличенное трехмерное изображение камеры, механические манипуляторы с семью степенями свободы движения, возможность масштабирования и снижение тремора [5]. РАЦЭ стала лучшей альтернативой открытой ЦЭ (ОЦЭ) из-за снижения кровопотери, болевого синдрома, а также более быстрого восстановления функции кишечника [6, 7]. Также немаловажно, что ОЦЭ и РАЦЭ сопоставимы по радикальности [8]. РАЦЭ постепенно внедряются в рутинную клиническую практику, обеспечивая снижение кровопотери и болевого синдрома, лучший косметический эффект, меньшее число анастомотических стриктур, и снижение послеоперационного койко-дня [9, 10].
Цистэктомия (ЦЭ), «золотой стандарт» лечения МИРМП, характеризуется высокой частотой после- операционных осложнений. Не удивительно, что малоинвазивные доступы привлекают большое внимание урологов, занимающихся хирургическим лечением МИРМП [4]. Робот-ассистированная ЦЭ (РАЦЭ) имеет технические преимущества перед ла- пароскопической (ЛЦЭ): увеличенное трехмерное изображение камеры, механические манипуляторы с семью степенями свободы движения, возможность масштабирования и снижение тремора [5]. РАЦЭ стала лучшей альтернативой открытой ЦЭ (ОЦЭ) из-за снижения кровопотери, болевого синдрома, а также более быстрого восстановления функции кишечника [6, 7]. Также немаловажно, что ОЦЭ и РАЦЭ сопоставимы по радикальности [8]. РАЦЭ постепенно внедряются в рутинную клиническую практику, обеспечивая снижение кровопотери и болевого синдрома, лучший косметический эффект, меньшее число анастомотических стриктур, и снижение послеоперационного койко-дня [9, 10].
Ряд хирургических центров провели сравнительные исследования РАЦЭ с экстра- и инстракорпоральном отведением мочи (ЭОМ и ИОМ, соответственно) [11-21]. ЭОМ технически проще, а по- тому при малом опыте выполнения РАЦЭ характеризуются меньшим уровнем осложнений. Частота применения ИОМ неуклонно растет: с 2005 г. она увеличилась на 11% в год, – однако РАЦЭ с ИОМ пока остаются прерогативой центров с большим объемом операций [22]. Формирование механизма отведения мочи является сложнейшим этапом операции. Выбор механизма должен точно соответствовать нуждам конкретного пациента. После выполненной ЦЭ моча может быть отведена в инконтинентную стому, континентный мочевой резервуар, катетеризируемый самим пациентом или контролируемый анальным сфинктером, или же в ортотопический мочевой пузырь, позволяющий пациенту мочить- ся через мочеиспускательный канал. J. Simon в 1852 г. впервые стал использовать для отведения мочи сегмент кишечника [23]. Наиболее простой вариант уретерокутанеостома использовался из- начально, в последующем было отмечено частое развитие стриктуры дистального отдела мочеточников, что в свою очередь приводило к хронической почечной недостаточности, что свело к минимуму использование данной техники. В настоящее время чаще используются варианты кишечной пластики. Однако до открытия антибактериальных препаратов выполнение кишечной пластики зачастую приводило к развитию перитонита. В 1911 г. R.S. Coffey предложил уретеросигмостомию, ставшую наиболее популярным механизмом отведения мочи, но относительно высокий риск развития ЗНО кишечника снизил частоту использования данного метода [24]. В 1911 г. F.J. Zaayer предложил формировать кондуит из подвздошной кишки, в последующем времени, в 1950 г. данная методика была модифицирована и представлена в качестве стандартной E.M. Bricker [25]. В 80-х гг. были описаны различные варианты формирования континентных резервуаров из подвздошной кишки [26, 27], илеоцекального сегмента (Mainz II) [28, 29], прямой кишки [30]. Выбор техники формирования механизма отведения мочи зависит от предпочтения уролога. Тактика определения механизма от- ведения мочи при РАЦЭ требует дальнейшего изучения и стандартизации. Основной задачей данного исследования является анализ непосредственных и отдаленных результатов РАЦЭ с целью оценки онкологических и функциональных результатов у больных с МИРМП.
Материалы и методы
В урологическом отделении ФГБУ “НМИЦ хирургии им. А.В. Вишневского” МЗ РФ в промежутке с 2019 по 2021 гг. было проведено 6 РАЦЭ, все 6 клинических случаев были включены в данную работу. У всех пациентов морфологически подтвержденное ЗНО мочевого пузыря стадии рT1-3b,N0-1,M0-1. Все опухоли были представлены уротелиальным раком высокой степени злокачественности. Методика заключалась в выполнении РАЦЭ с последующим применением различных вариантов деривации мочи. Все пациенты были мужчинами, средний возраст которых со- ставил 60,5±3,7 лет. У одного пациента (17%) имел место первично-множественный метахронный рак (второй локализацией являлась предстательная железа). Класс предоперационного риска по классификации ASA оценен как I-II у всех пациентов (100%). Перед оперативным пособием проводились клинико-лабораторные исследования, компьютерная томография легких, компьютерная или магнитно-резонансная томография органов малого таза. Операционный материал отправлялся на гистологическое исследование. Стадия pT1 выявлена у 4 (66,6%) больных, рТ2а ‒ у 1 (16,7%), рТ3 ‒ у 1 (16,7%). По данным морфологического исследования были выявлены регионарные метастазы у 1 пациента (16,7%). У всех пациентов при гистологическом исследовании диагностирована инвазивная уротелиальная карцинома high-grade. Во всех случаях проводилась расширенная тазовая лимфаденэктомия.
В 1 (16,7%) случае после выполненной ЦЭ из-за невозможности ретроградного стентирования мочеточника перед пластическим этапом была произведена конверсия и реконструктивная часть операции была выполнена открыто. Также в 1 (16,7%) случае при гетеротопической пластике вообще не производилось ретроградного стентирования обоих мочеточников. Методами деривации мочи после выполненной РАЦЭ были: уретерокутанеостомия у 3 (50%) пациентов, операция Bricker у 2 (33,3%), 1 (16,7%) больному было выполнено формирование ортотопического необладдера по методике Studer.
Методика выполнения РАЦЭ
Все РАЦЭ выполнялись на роботизированной системе Da Vinci Si. В положении Тренделенбурга под 30-45° максимально широко разведенными ногами после введения в наркоз и трехкратной обработки операционного поля, устанавливались роботические и ассистентские троакары. На всех операция была применена техника с 6 портами. После инсуффляции брюшной полости до 10-12 мм.рт.ст. с использованием иглы Вереша, производилась установка порта камеры на 1 см выше пупка. В дальнейшем выполнялись ревизия брюшной полости и установка оставшихся троакаров под контролем зрения. Первые два роботических порта позиционировались по линии пупка справа и слева от латеральных краев прямых мышц живота, третий роботический порт находил свое место в 1 см выше и кнаружи от левой передней верхней подвздошной ости. Первый ассистентский порт устанавливался зеркально третьему роботическому, а второй ‒ на 3 см выше от середины расстояния между пупком и первым роботическим портом, расположенным справа (рис. 1).
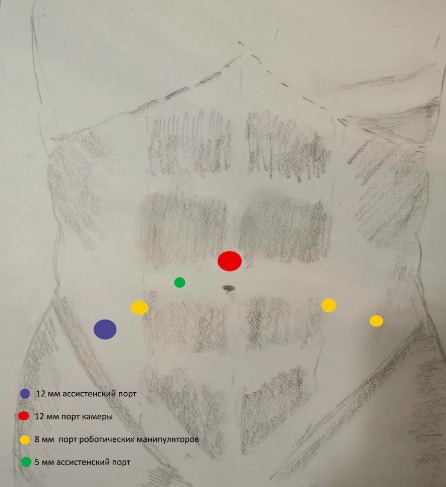 Схема расстановки роботических портов
Схема расстановки роботических портов
Одним из основных этапов являлась подвздошно-обтураторная лимфаденэктомия. Выделялась наружная подвздошная артерия и вена слева, удалялась клетчатка и лимфоузлы окружающие данные сосуды с использованием биполярной коагуляции. Выделялась развилка подвздошных сосудов, удалялась клетчатка из данной области, обрабатывалась внутренняя подвздошная артерия и вена, а также обтураторная область с выделением обтураторного нерва и сохранением обтураторной артерии. Затем, выделялась наружная подвздошная артерия и вена справа, удалялась клетчатка и лимфоузлы окружающие данные сосуды с использованием биполярной коагуляции. Выделялась развилка подвздошных сосудов, удалялась клетчатка из данной области, обрабатывалась внутренняя подвздошная артерия и вена, а также обтураторная область с выделением обтураторного нерва. При непосредственном выполнении ЦЭ, в первую очередь проводилась мобилизация обоих мочеточников от уровня их пересечения с подвздошными сосудами до стенки мочевого пузыря. В непосредственной близости от юкставезикального отдела каждого мочеточника накладывались по две клипсы, между которыми они пересекались, с целью обеспечения необходимой мобильности мочеточника при проведении слева направо сквозь окно в брыжейке сигмовидной кишки. Дистальные части мочеточников отсекались и отправлялись на гистологическое исследование.
Следующим шагом выполнялось выделение семенных пузырьков с семявыносящими протоками и мобилизация задней стенки мочевого пузыря, переходящая ниже в ретропростатическую диссекцию [31]. Все представленные в этой статье оперативные пособия проводились без применения нервосберегающей методики, максимально радикально. Далее мочевой пузырь и предстательная железа мобилизовались с обеих сторон. Для этого париетальную брюшину рассекали латеральнее медиальных пупочных связок. Попеременно используя острую и тупую диссекцию забрюшинное пространство расширялось вплоть до тазовой фасции. В процессе диссекции клипировались и пересекались сосуды мочевого пузыря и латеральной поверхности простаты. Переходя к мобилизации передней стенки мочевого пузыря и простаты, урахус и медиальные пупочные связки коагулировали биполярным диссектором и пересекали, выделяли переднюю стенку мочевого пузыря и предстательной железы. Дорсальный венозный комплекс (сплетение Санторини) перевязывали и пересекали, выполняли апикальную диссекцию простаты и уретры на протяжении. В случае выполнения гетеротопической пластики или уретерокутанеостомии отверстие уретры ушивалось. При выполнении ор- тотопической цистопластики к нему соответственно подшивался сформированный необладдер.
При интракорпоральном формировании подвздошного кондуита изолировалось 20 см кишечника, отступя как минимум 25 см от илеоцекального клапана, при помощи кишечного сшивающего аппарата. Через 15 мм порт аассистент проводил степлер. По стандартной методике при помощи кишечного степлера восстанавливалась проходимость кишечника. Во всех случаях накладывался аппаратный антиперистальтический анастомоз бок в бок (рис. 2). В туннеле брыжейки сигмовидной кишки проводился направо левый мочеточник. Затем выполнялась спатуляция мочеточников длиной около 2 см. Далее либо проводилось стентирование обоих мочеточников при помощи наружных J-стентов, проведенных через подвздошный сегмент, которые крепились к коже, либо мочеточниковый анастомоз накладывался без деривационных дренажей (рис. 3). При помощи 4-0 монофиламентного материала формировался анастомоз между мочеточниками и тонкокишечным кондуитом. В конце операции формировалась стома в заранее выбранном месте. Предпочтительным местом формирования стомы является место установки ассистенского троакара справа. При формировании ортотопического резервуара проводится детубуляризация изолированного сегмента подвздошной кишки длинной 55 см (рис. 4)
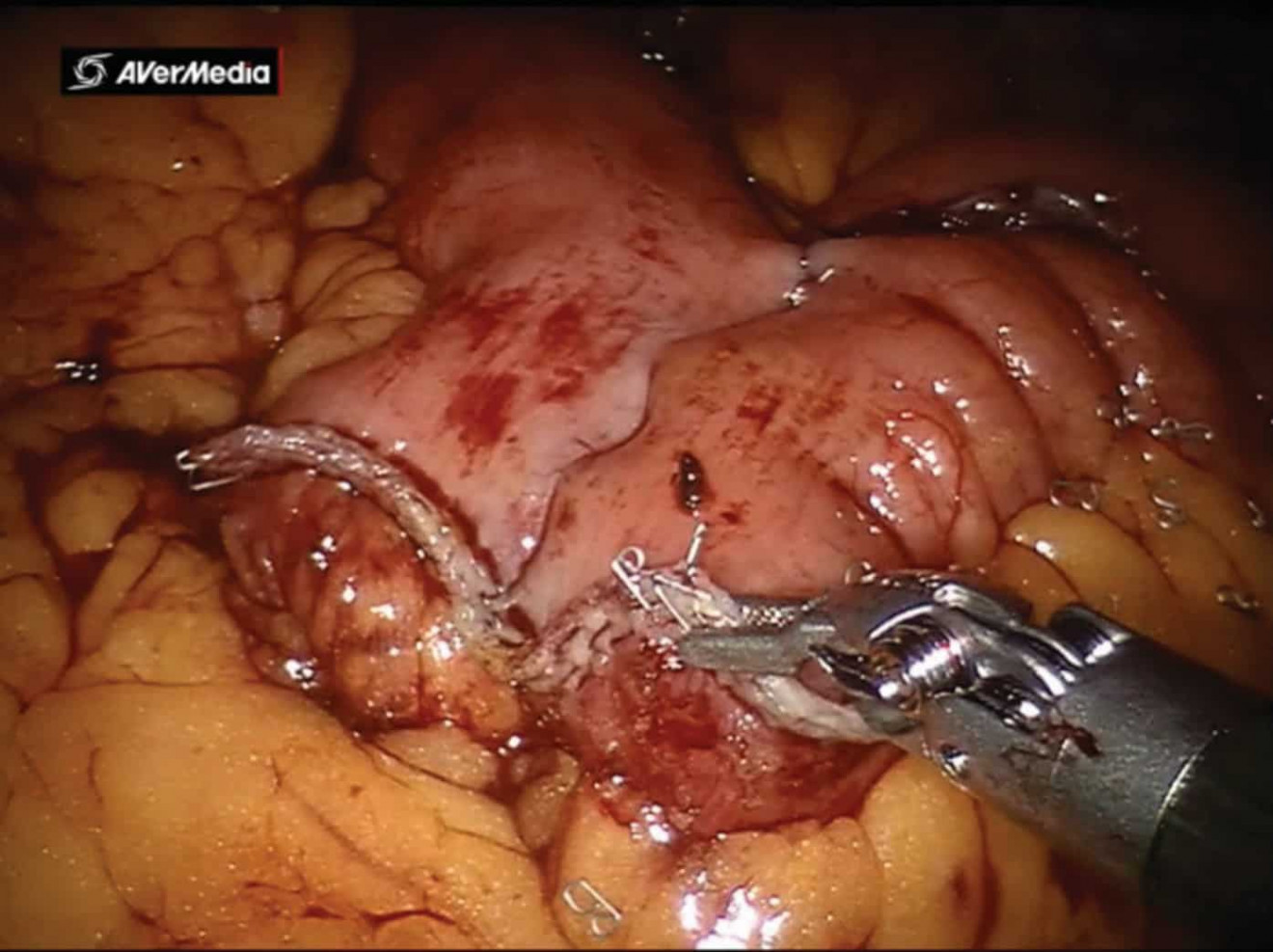 Рис. 2. Аппаратный антиперистальтический анастомоз конец в конец (интраоперационное фото)
Рис. 2. Аппаратный антиперистальтический анастомоз конец в конец (интраоперационное фото)
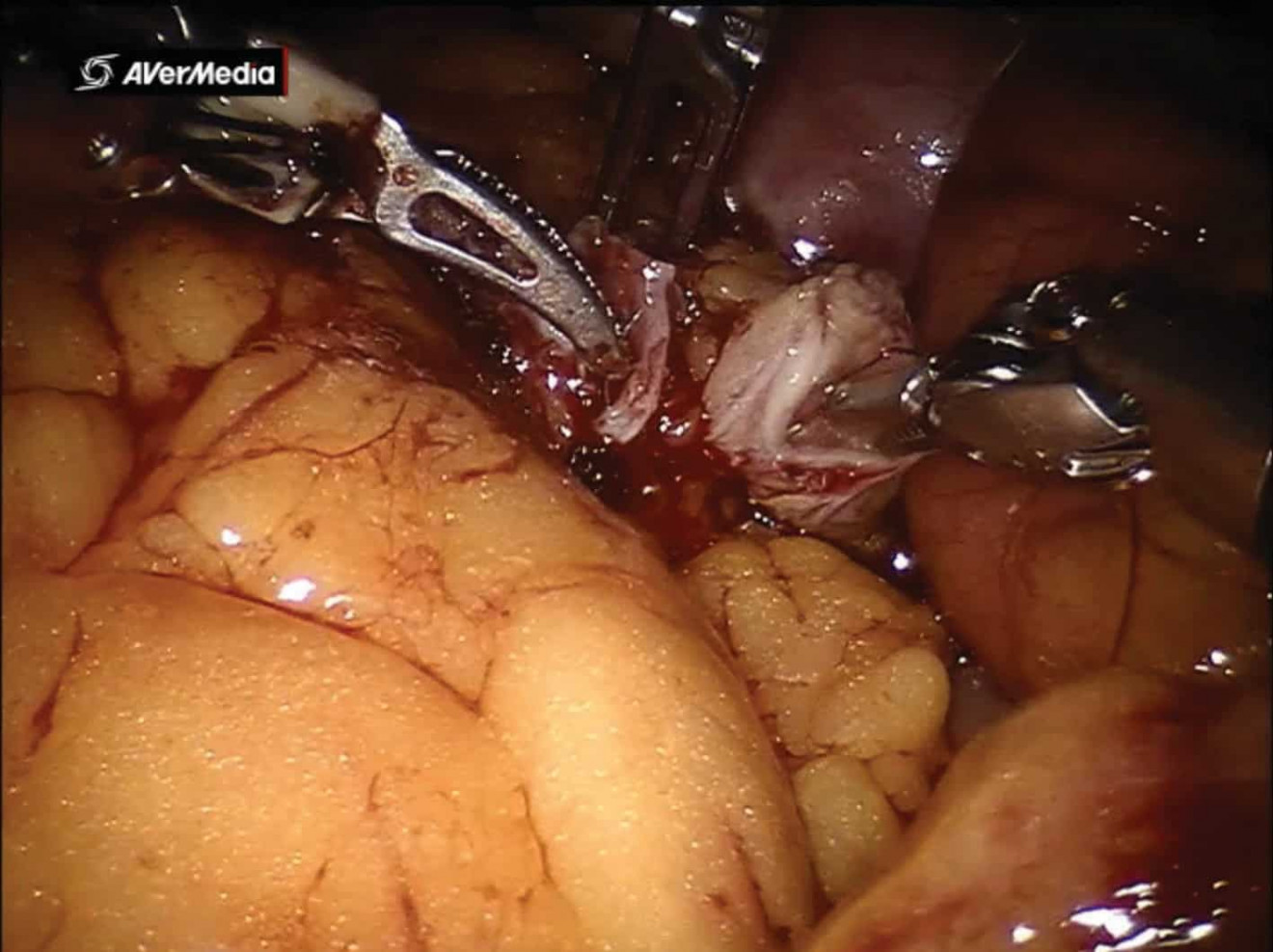 Рис. 3. Формирование межмочеточникового анастомоза по Wallace бок в бок (интраоперационное фото)
Рис. 3. Формирование межмочеточникового анастомоза по Wallace бок в бок (интраоперационное фото)
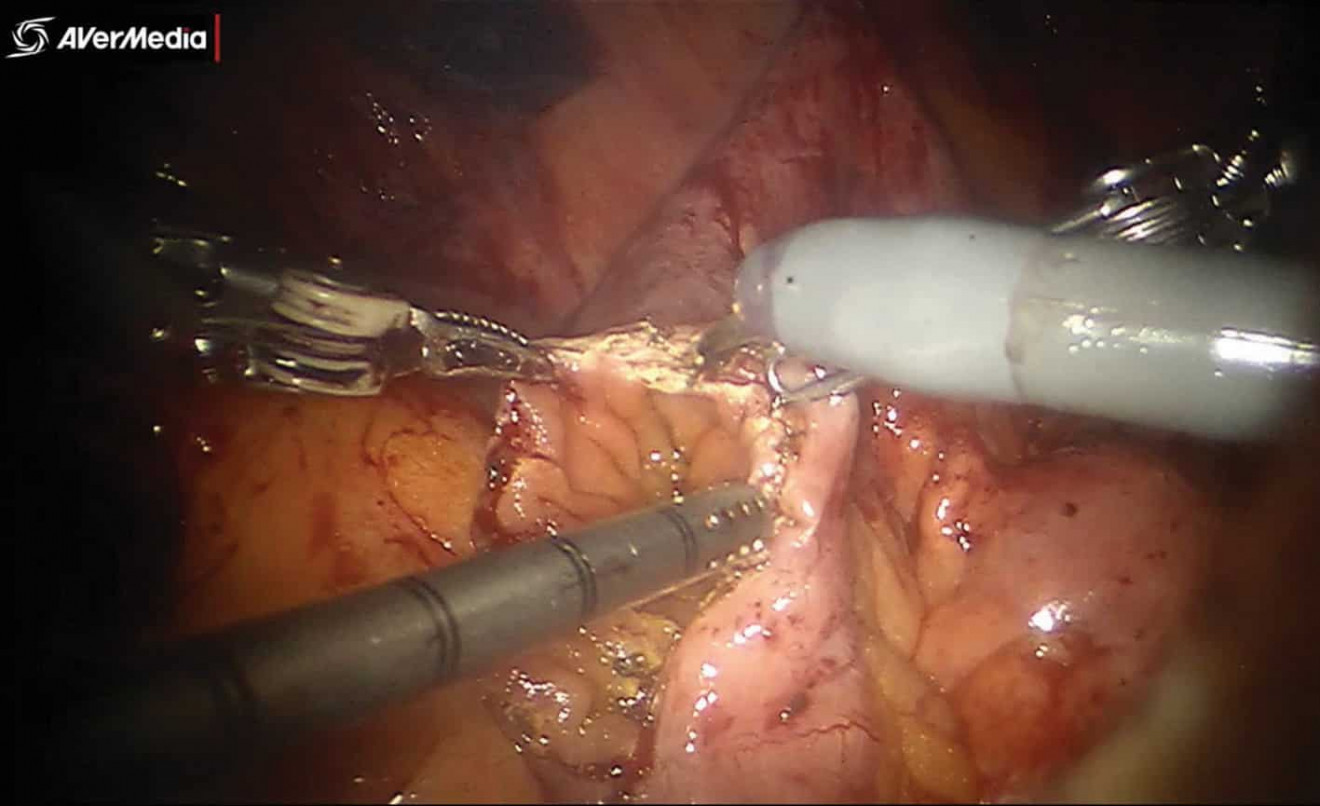 Рис. 4. Этап формирования необладдера (интраоперационное фото)
Рис. 4. Этап формирования необладдера (интраоперационное фото)
Интракорпоральное формирование необладера выполнялось непрерывным викриловым швом 3\0, как передней, так и задней стенки ортотопического резервуара. Весь удаленный макропрепарат помещался в эндобэг и в конце операции, после удаления троакаров, извлекался через расширенную рану порта камеры.
Результаты
Средняя продолжительность операции составила 432±122 мин. Время операции коррелировало со способом отведения мочи: интракорпоральная методика формирования необладдера по Штудеру характеризовалась наибольшей продолжительностью. Средний объем кровопотери составил 150±70,5 мл. R0 достигнут в 5 (83%) случаев. В послеоперационном периоде не отмечено осложнений выше I степени по Clavien-Dindo. Средняя длительность пребывания в стационаре пациентов с уретерокутанеостомией составила 9 cуток, при выполнении операции Bricker – 20,5±0,5 суток, а при формировании необладдера – 25 суток. На данный момент наиболее длительный период наблюдения составляет 11 месяцев, что не позволяет судить об отдаленных результатах. Ни в одном из случаев не выявлено рецидивирования и прогрессирования. Летальных исходов не было. Через 6 месяцев с момента выполнения ортотопической пластики мочевого пузыря по методике Studer отсутствуют признаки местного, регионарного и отдаленного метастазирования. Функция верхних мочевыводящих путей также без нарушения мочеоттока (рис. 5).
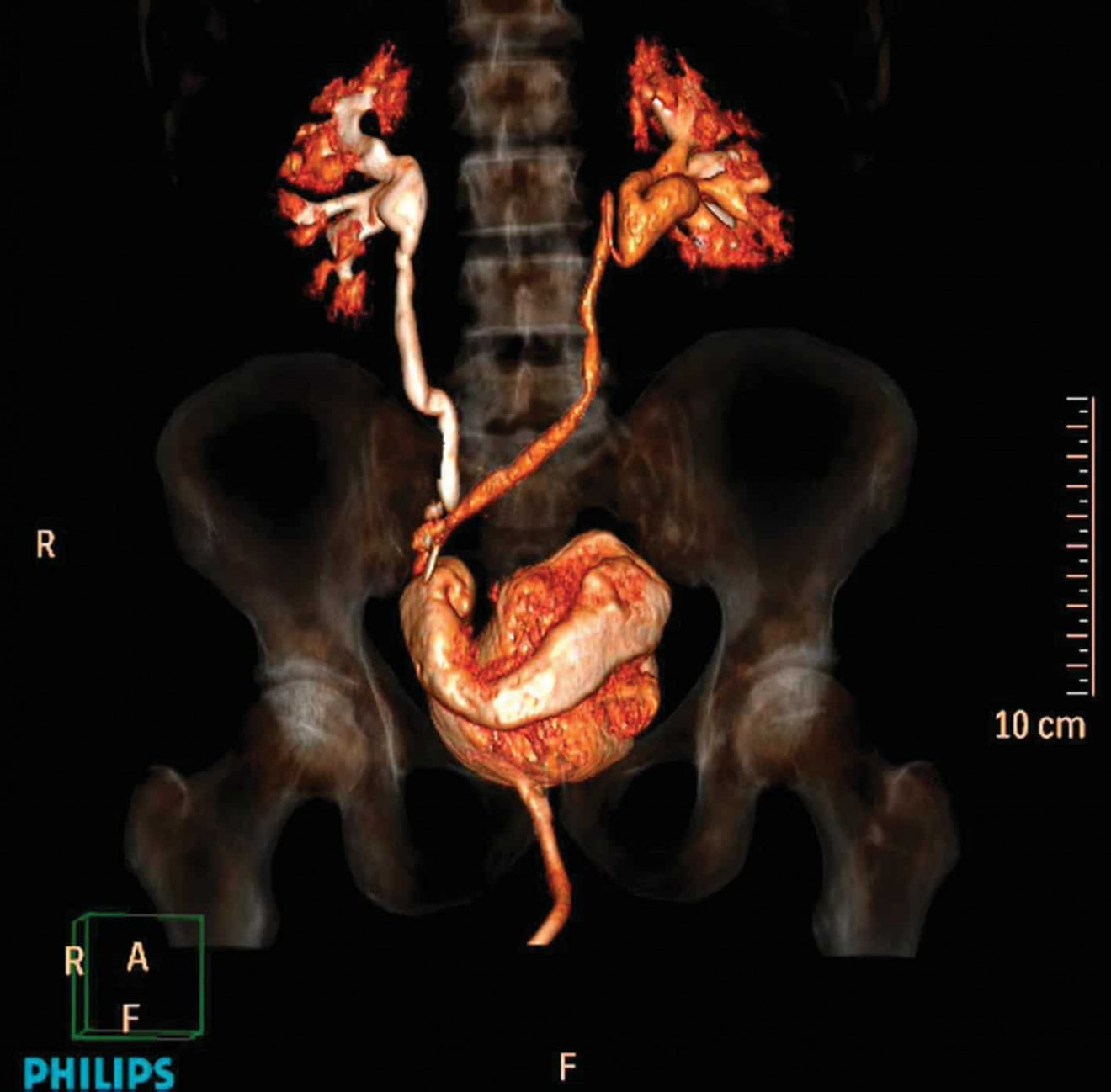 Рис. 5. 3-D реконструкция МСКТ мочевыделительной системы больного через 6 месяцев после роботической ортотопической пластики по Studer на Da Vinci Si
Рис. 5. 3-D реконструкция МСКТ мочевыделительной системы больного через 6 месяцев после роботической ортотопической пластики по Studer на Da Vinci Si
Обсуждение
Двадцать лет хирургической эволюции можно считать коротким периодом для того, чтобы радикальная процедура стала методом выбора, но РАЦЭ показывает многообещающие результаты по сравнению с текущим «золотым стандартом», открытой ЦЭ [32]. ЦЭ – это хирургическая процедура с высокой частотой послеоперационных осложнений, которая требует минимизации хирургических осложнений. Кроме того, ЦЭ должна быть нацелена на обеспечение хороших функциональных результатов. Задача хирургов, занимающихся РМП, состоит в том, чтобы искоренить болезнь и обеспечить приемлемое послеоперационное качество жизни. В этой связи малоинвазивная хирургия и особенно РАЦЭ стала альтернативой открытой хирургии, одной из основных задач которой стало снижение интраоперационных осложнений. Несмотря на то, что РА хирургия продвинулась вперед, опыт в области интракорпоральной реконструкции деривации мочи, включая интракорпоральный подвздошный кондуит или реконструкцию необладдера, остается ограниченным. Большинство хирургов применяют гибридный подход РАЦЭ и ЭОМ, так как ИОМ, особенно интракорпоральная реконструкция необладдера, остается технически сложной задачей [33, 34].
Очевидными преимуществами полностью интракорпоральной техники являются защита кишечника внутри брюшной полости, отсутствие переохлаждения или потери жидкости из-за осмоса, низкий уровень кровопотери, отсутствие необходимости обширного рассечения мочеточника, которое может привести к стриктурам мочеточника, и минимальная хирургическая травма [35]. Немаловажную роль в развитии послеоперационных осложнений имеет вид реконструкции мочевыводящих путей [36]. Как бы то ни было, не стоит забывать, что МИР-МП – это системное заболевание с отдаленными метастазами, поражением лимфатических узлов и местным рецидивом, часто вызываемым микрометастазами на момент постановки диагноза. Поэтому ранняя системная терапия важна для устранения риска микрометастазов за пределами операционного поля [7].
Выводы
РАЦЭ – современный метод хирургического лечения, сопоставимый по своей эффективности с открытым вмешательством. РАЦЭ, по-видимому, является эффективной альтернативой ЦЭ с преимуществами меньшего количества периоперационных осложнений, однако нужно быть готовым к большей себестоимости и длительности самого вмешательства. ЦЭ – одна из самых сложных и травматичных операций в современной урологии, при которой особенно непросто соблюсти баланс онкологической радикальности и функциональных исходов. Опыт хирурга и центра в целом положительно сказывается на результатах лечения. Однако самой процедуры может быть недостаточно для излечения, поскольку мы имеем дело с агрессивным раком. В будущем выживаемость может быть улучшена за счет оптимальных протоколов неоадъювантной или адъювантной химиотерапии. Дальнейшее накопление опыта и наблюдение отсроченных онкологических результатов призваны сформировать понимание места РАЦЭ в лечении больных с МИРМП и НМИРМП с высоким риском прогрессирования.

